Cần bao nhiêu gam dung dịch NaOH 6% trộn với bao nhiêu gam dung dịch NaOH 12% để được 150g dung dịch NaOH 10%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


10.2 :
a) \(n_{HCl\left(bđ\right)}=0,8\left(mol\right)\)
Giả sử HCl dư
PTHH : \(KHSO_3+HCl-->KCl+SO_2+H_2O\)
\(K_2CO_3+2HCl-->2KCl+H_2O+CO_2\)
Có : \(M_X=25,333\cdot2=50,666\) (g/mol)
Dùng pp đường chéo :
=> nSO2 = \(\dfrac{1}{2}\)nCO2
=> nKHSO3 = \(\dfrac{1}{2}\)nK2CO3
Đặt \(\left\{{}\begin{matrix}n_{KHSO_3}=a\left(mol\right)\\n_{K_2CO_3}=b\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}120a+138b=39,6\\a=\dfrac{1}{2}b\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
=> \(n_{HCl\left(pứ\right)}=n_{KHSO_3}+2n_{K_2CO_3}=0,5\left(mol\right)\) < 0,8 => HCl dư (giả sử đúng)
b) Theo ĐLBTKL :
\(m_{dd\left(spu\right)}=m_{hh}+m_{ddHCl}-m_X=39,6+400-\left(0,1\cdot64+0,2\cdot44\right)=424,4\left(g\right)\)
Có : \(tổng.n_{KCl\left(spu\right)}=n_{HCl\left(pứ\right)}=0,5\left(mol\right)\)
=> \(\left\{{}\begin{matrix}C\%KCl=\dfrac{74,5\cdot0,5}{424,4}\cdot100\%=8,78\%\\C\%HCl=\dfrac{\left(0,8-0,5\right)\cdot36,5}{424,4}\cdot100\%=2,58\%\end{matrix}\right.\)

Đáp án A.
Hướng dẫn :
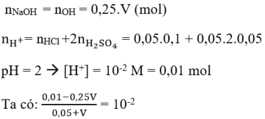
⇒ 0,01 - 0,25.V = 0,01.0,05 + 0,01 V à 0,26.V = 0,01 - 0,01.0,05
⇒ V = 0,0365 l = 36,5 ml

Đáp án A
Số mol Al = 0.81/27= 0,03 (mol); số mol HCl = 0,55.0,2 = 0,11 (mol)
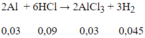
Dung dịch A thu được gồm AlCl3 = 0,03 mol; HCl = 0,11 - 0,09 = 0,02 mol.
Để có lượng kết tủa lớn nhất:
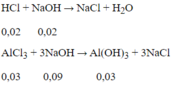
Thể tích dung dịch NaOH cần dùng

Đáp án : C
Fe được hòa tan hoàn toàn bởi dd HNO3 thu được dd X, khi thêm HCl vào X có khí NO thoát ra → trong X có ion Fe2+ → HNO3 đã phản ứng hết
n(NO) = 1,12/22,4 = 0,05 mol
Fe + 4HNO3 → Fe(NO3)3 + NO + 4H2O
0,05 -> 0,2 -> 0,05
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
x -> 3x
Theo ĐL bảo toàn nguyên tố, số mol NO3- có trong muối:
n(NO3- trong muối) = n(HNO3) - n(NO) = 0,15 mol
n(NaOH) = 0,115.2 = 0,23 mol
Sau khi NaOH pư hoàn toàn với các chất trong dd Y, dung dịch thu được có:
n(Na+) = n(NaOH) = 0,23 mol; n(Cl-) = n(HCl) = 0,1 mol → n(NO3-) = n(Na+) - n(Cl-) = 0,23 - 0,1 = 0,13 mol → Số mol NO3- bị Fe2+ khử: 0,15 - 0,13 = 0,02 mol
NO3- + 3Fe2+ + 4H+ → 3Fe3+ + NO + 2H2O
0,02 -> 0,06 -> 0,08
NO3- và H+ đều dư (H+ dư 0,02mol) → Fe2+ đã phản ứng hết
→ 3x = 0,06 → x = 0,02 mol
Tổng số mol Fe: n(Fe) = 0,05 + x = 0,07 mol
Khối lượng Fe đã sử dụng: m(Fe) = 0,07.56 = 3,92g


Đặt x,y lần lượt là khối lượng dung dịch của NaOH 6% và NaOH 12%
Áp dụng quy tắc đường chéo :
=> \(\dfrac{x}{y}=\dfrac{2}{4}=\dfrac{1}{2}\) (1)
mặt khác : x+y=150(2)
giải hệ (1),(2)=> x=? y=?