Hỗn hợp A gồm Mg và Zn, dung dịch B là H2SO4 có nồng độ là x/X(mol)
Trường hợp 1: Cho 48,6 g A vào 4 lít B sinh ra 17,92l H2(đktc)
Trường hợp 2: Cho 48,6 g A vào 6 lít B sinh ra 22,4 lít khí H2(đktc)
a.Chứng minh trong trường hợp 1 : hỗn hợp Kim laoi5 chưa tan hết , trường hợp 2 : axit còn dư
b/ Tính nồng độ x/X(mol) của dung dịch B và thành phần phần trăm theo khối lượng của Mg, Fe trong hỗn hợp


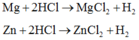



Mg + H2SO4 -> MgSO4 + H2 (1)
Zn + H2SO4 -> ZnSO4 + H2 (2)
a;
Trong các TH cùng một lượng A nhưng ở TH1 thì H2 sinh ra ít hơn ở TH2 nên ở TH1 thì kim loại tan chưa hết;ở TH2 axit dư
b;Ở TH1:kim loại dư
Theo PTHH 1và 2 ta có:
nH2SO4=nH2=0,8(mol)
CM dd H2SO4=\(\dfrac{0,8}{4}=0,2M\)
Ở TH2:axit dư
Đặt nMg=a
nZn=b
Ta có hệ:
\(\left\{{}\begin{matrix}24a+65b=48,6\\a+b=1\end{matrix}\right.\)
=>a=0,4;b=0,6
mMg=24.0,4=9,6(g)
mZn=65.0,6=39(g)