Ngâm một vật bằng đồng có khối lượng 5g trong 250 g dung dịch AgNO3 8% chỉ sau một thời gian ngắn Lấy vật ra và kiểm tra thấy khối lượng AgNO3 trong dung dịch bắt đầu giảm 85%
a) tính khối lượng vật lý ra sao Khi lau khô
b) tính nồng độ phần trăm của các chất hòa tan trong dung dịch phản ứng sau khi Lấy vật ra


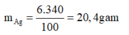
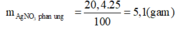
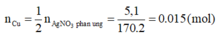


Khối lương AgNO3 = 250.4/100 = 10 gam; khối lượng AgNO3 giảm 17% có nghĩa là giảm 10.17/100 = 1,7 gam ---> số mol AgNO3 = 1,7/170 = 0,01 mol (tham gia phản ứng)
Cu + 2AgNO3 ------> Cu(NO3)2 + 2Ag
0,005 0,01 0,01
Khối lượng thanh Cu tăng thêm: 0,01.108 - 0,005.64 = 0,76 gam
Khối lượng vật sau pu là 10,76 gam
(Cứ tan ra 0,32 gam đồng thì sinh ra 1,08 gam Ag bám vào vật bằng Cu do đó vật tăng 10 + 0,76 gam)
trên đề là 8% chứ không phải là 4%. tính sai ngay từ đầu