Bài tập ôn thi Hóa lý
Cho cân bằng N2O4 = 2NO2 ở 300C.
Giả sử ban đầu trong bình chỉ có N2O4 với áp suất là 760 mmHg. Khi phản ứng đạt cân bằng, áp suất trong bình là 800 mmHg.
a) Tính các loại hằng số cân bằng của phản ứng.
b) Xác định độ điện ly của N2O4 tại thời điểm áp suất trong bình là 780 mmHg.
c) Tính hiệu ứng nhiệt của phản ứng trên nếu biết hằng số cân bằng của phản ứng ở 250C là 1,15 mmHg.


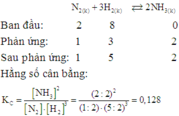

Huy: có phải Kc bạn tính sai r k?