Bài 8. Lấy V1 lít HC1 0.6M trộn V2 lít NaOH 0,4M. Tổng V1+V2= 0,6 lít thu được dung dịch A.biết rằng 0,6 lít dung dung dịch A tác dụng vừa đủ với 0,02 mol Al2O3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nHCl=0,6V1 mol; n NaOH=0,4V2 mol
Do dd A có thể hòa tan Al2O3=> HCl hoặc NaOH dư
*TH1: HCl dư
Al2O3+6HCl-> 2AlCl3+3H2O nAl2O3=0,01 mol=> nHCl dư =0,06 mol
nHCl phản ứng= n NaOH=0,4V2 mol=>n HCl dư = 0,6V1-0,4V2=0,06 mol
V1+V2=0,6l
giải hpt ra V1=V2=0,3l
*TH2: NaOH dư
2NaOH+Al2O3-> 2NaAlO2+H20 (3)
n NaOH dư=2nAl2O3=0,02 mol
=>nNaOH dư= 0,4V2-0,6V1=0,02 mol
V1+V2=0,6l
giải hpt ra V1=0,22l, V2=0,38l

Đáp án A
nH+ = 0,04V1 (mol); nOH-= 0,035V2 (mol)
H++ OH- → H2O
Dung dịch sau phản ứng có pH = 2 nên axit dư
nH+ dư = 0,04V1- 0,035V2
[H+]dư = nH+ dư/ Vdd = (0,04V1- 0,035V2)/(V1+ V2) = 10-2
Suy ra V1/V2 = 3/2

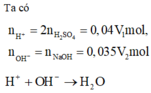
Để thu được dung dịch có pH = 2 chứng tỏ dung dịch sau phản ứng chứa axit dư [H+] dư = 0,01 M
→ nH+(du) = 0,04V1-0,035V2 = 0,01.(V1 + V2) → 0,03V1 = 0,045V2 → V1 : V2 = 3:2
Đáp án B

nHCl = V1 mol
n NaOH = 2V2 mol
Trường hợp 1: Dung dịch X chứa HCl dư
HCl + NaOH → NaCl + H2O
2V2<----2V2
3HCl + Al(OH)3 → AlCl3 + 3H2O
3a<-------a
=> nHCl = 2V2 + 3a = V1
Trường hợp 2: Dung dịch X chứa NaOH
HCl + NaOH → NaCl + H2O
V1------>V1
Al(OH)3 + NaOH → NaAlO2 + 2H2O
a------------> a
n NaOH = V1 + a = 2V2



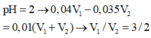

$n_{HCl} = 0,6V_1(mol) ; n_{NaOH} = 0,4V_2(mol)$
$V_1 + V_2 = 0,6(1)$
TH1 : HCl dư
$n_{HCl\ dư} =0,6V_1 - 0,4V_2 (mol)$
$Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2$
$n_{HCl\ dư} = 6n_{Al_2O_3} = 0,12(mol)$
$\Rightarrow 0,6V_1 - 0,4V_2 = 0,12(2)$
Từ (1)(2) suy ra $V_1 = 0,36(lít) ; V_2 = 0,34(lít)$
TH2 : NaOH dư
$n_{NaOH\ dư} = 0,4V_2 - 0,6V_1(mol)$
$2NaOH + Al_2O_3 \to 2NaAlO_2 + H_2O$
$n_{NaOH\ dư} = 0,4V_2 - 0,6V_1 = 2n_{Al_2O_3} = 0,04(3)$
Từ (1)(3) suy ra $V_1 = 0,2(lít) ; V_2 = 0,4(lít)$
AlO3 là chất gì em ha? Hay là Al2O3
Em xem lại đề em nha!