Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
HD• (1) sai vì trong bảng hệ thống tuần hoàn gồm có 14 nguyên tố s: 7 nguyên tố nhóm IA, 6 nguyên tố nhóm IIA và He.
(b) sai vì khối các nguyên tố p là những nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He) → bảng tuần hoàn gồm 36 nguyên tố.
(c) đúng.
(d) đúng.
(e) sai vì bảng tuần hoàn có 18 cột dọc, ứng với 8 nhóm A và 8 nhóm B.
(g) sai. VD Ar (Z = 18) MAr = 39,948; K (Z = 19) MK = 39,0983.
(h) sai vì Mendeleev xếp các nguyên tố vào bảng tuần hoàn theo chiều tăng dần của khối lượng nguyên tử.
→ Có 2 mệnh đề đúng.

C
Nguyên tố Y là nguyên tố thuộc nhóm B nên cấu hình electron lớp sát ngoài cùng và ngoài cùng có dạng: 3 d a 4 s 2 (hoặc 3 d b 4 s 1 trong trường hợp Cr và Cu).
Vậy số electron hóa trị của Y≥3. Y là kim loại, Y không có phân lớp f.
Nguyên tố X là nguyên tố thuộc nhóm A, có ≥3 electron hóa trị (vì cùng số electron hóa trị với Y).
=> electron cuối cùng của X sẽ nằm trên phân lớp p (x là nguyên tố p)
Chưa thể xác định được X và kim loại hay phi kim.

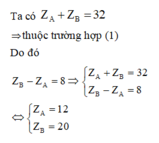
Trong cùng một nhóm A, theo chiều tăng dần của điện tích hạt nhân, khoảng cách giữa electron lớp ngoài cùng đến hạt nhân tăng, lực liên kết giữa electron lớp ngoài cùng và hạt nhân giảm, do đó năng lượng ion hóa nói chung giảm.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực liên kết giữa hạt nhân và electron lớp ngoài cùng tăng làm cho năng lượng ion hóa nói chung cũng tăng theo.
→ Nguyên tố có năng lượng ion hóa I 1 nhỏ nhất là nguyên tố thuộc nhóm IA, chu kì 7 → Fr.
Nguyên tố có năng lượng ion hóa lớn nhất là nguyên tố thuộc nhóm VIIA, chu kì 2 → F.
→ Chọn D.