K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Dưới đây là một vài câu hỏi có thể liên quan tới câu hỏi mà bạn gửi lên. Có thể trong đó có câu trả lời mà bạn cần!

18 tháng 2 2017
Đáp án A
nH+ = 0,2.0,1 + 0,2.2.0,05 = 0,04
Sau phản ứng thu được 500ml dung dịch có pH =13 ⇒ nOH- lúc sau = 0,05
⇒ nBa =1/2 nOH- ban đầu = 0,045 ⇒ a = 0,045 ÷ 0,3 = 0,15
nH2SO4 = 0,2.0,05 = 0,01< n Ba = 0,045 ⇒ n↓ = n H2SO4 = 0,01 mol
⇒ m↓ = 2,33g
Đáp án A.

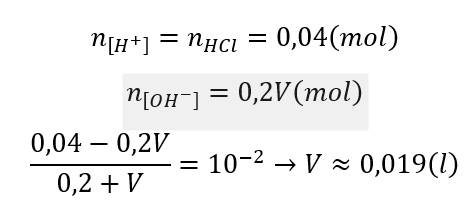

\(n_{H^{^{ }+}}=0,2x\left(mol\right);n_{OH^-}=0,3.0,05.2=0,03mol\\ pH=1\Rightarrow H^+:dư\left(0,2x-0,03\left(mol\right)\right)\\ pH=-log\left[H^+\right]\Rightarrow1=-log\left(0,2x-0,03\right)\\ x=0,65\)