Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Phương trình điện li:
MgSO4 ® Mg2+ + SO42-
0,1 0,1 (mol)
Al2(SO4)3® 2Al3+ + 3 SO42-
0,1 0,3 (mol)
n S O 4 2 − = 0 , 4 m o l
⇒ C M ( S O 4 2 − ) = 0 , 4 0 , 5 = 0 , 8 M

a, \(n_{HCl}=0,2.0,1=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,2.0,15=0,03\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{H^+}=0,02+0,06=0,08\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,3.0,05=0,015\left(mol\right)=n_{Ba^{2+}}\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,03___0,03 (mol) ⇒ nH+ dư = 0,05 (mol)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,015___0,015______0,015 (mol) ⇒ nSO42- dư = 0,015 (mol)
⇒ m = mBaSO4 = 0,015.233 = 3,495 (g)
\(\left[Cl^-\right]=\dfrac{0,02}{0,2+0,3}=0,04\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,05}{0,2+0,3}=0,1\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0,015}{0,2+0,3}=0,03\left(M\right)\)
b, pH = -log[H+] = 1

Đáp án D
• 0,42 mol NaOH + 0,02 mol Fe2(SO4)3; 0,04 mol Al2(SO4)3 → 500ml X + ↓
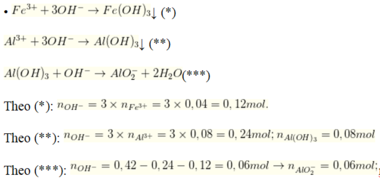
nAl(OH)3 = 0,08 - 0,06 = 0,02 mol
Vậy sau phản ứng 500ml dung dịch X gồm 0,06 mol Na[Al(OH)4]; 0,18 mol Na2SO4
→ CM các chất trong X là CMNa2SO4 = 0,06 : 0,5 = 0,12 M;
CMNa[Al(OH)4] = 0,18 : 0,5 = 0,36 M

Câu 1:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,6\cdot0,4+0,6\cdot0,3\cdot2=0,6\left(mol\right)\\n_{H^+}=0,2\cdot2,6=0,52\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) H+ hết, OH- còn dư \(\Rightarrow n_{OH^-\left(dư\right)}=0,08\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,08}{0,6+0,2}=0,1\left(M\right)\) \(\Rightarrow pH=14+log\left(0,1\right)=13\)
Bài 2:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,3\cdot1,6=0,48\left(mol\right)\\n_{H^+}=0,2\cdot1\cdot2+0,2\cdot2=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) OH- hết, H+ còn dư \(\Rightarrow n_{H^+\left(dư\right)}=0,32\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,32}{0,2+0,3}=0,64\left(M\right)\) \(\Rightarrow pH=-log\left(0,64\right)\approx0,19\)

Câu 3 :
\(pH=-log\left[H^+\right]=-log\left(0.1\right)=1\)
Câu 4 :
Chứa các ion : H+ , Cl-
Câu 5 :
\(n_{NaOH}=n_{HCl}=0.02\cdot0.1=0.002\left(mol\right)\)
\(\Rightarrow x=\dfrac{0.002}{0.01}=0.2\left(M\right)\)
Câu 1 :
Bảo toàn điện tích :
\(n_{SO_4^{2-}}=\dfrac{0.2\cdot2+0.1-0.05}{2}=0.225\left(mol\right)\)
\(m_{Muối}=0.2\cdot64+0.1\cdot39+0.05\cdot35.5+0.225\cdot96=40.075\left(g\right)\)
Câu 2 :
\(\left[Na^+\right]=\dfrac{0.15\cdot0.5\cdot2+0.05\cdot1}{0.15+0.05}=1\left(M\right)\)

a) \(m_{ddAl_2\left(SO_4\right)_3}=200\cdot1,2=240\left(g\right)\)
\(\Rightarrow m_{Al_2\left(SO_4\right)_3}=\dfrac{240\cdot28,5}{100}=68,4\left(g\right)\)
\(\Rightarrow n_{Al_2\left(SO_4\right)_3}=0,2mol\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al^{3+}}=2n_{Al_2\left(SO_4\right)_3}=0,4mol\\n_{SO^{2-}_4}=0,6mol\end{matrix}\right.\)
b) \(n_{HCl}=0,1\cdot3=0,3mol\) \(\Rightarrow n_{Cl^-}=0,3mol\)
\(n_{HNO_3}=0,1\cdot1=0,1mol\) \(\Rightarrow n_{NO^-_3}=0,1mol\)
\(\Sigma n_{H^+}=n_{HCl}+n_{HNO_3}=0,3+0,1=0,4mol\)



Đáp án C
nMgSO4= 0,1 mol; nAl2(SO4)3= 0,1 mol; Vdd= 0,5 lít
CMgSO4=0,2M; CMAl2(SO4)3= 0,2M
MgSO4 → Mg2++ SO42-
0,2M 0,2M
Al2(SO4)3→ 2Al3++ 3SO42-
0,2M 0,6M
[SO42-] = 0,8M