Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2KClO3-to>2KCl+3O2
0,2---------------------0,3
4P+5O2-to->2P2O5
--0,3-------0,12 mol
n KClO3=\(\dfrac{24,5}{122,5}=0,2mol\)
=>VO2=0,3.22,4=6,72l
=>m P2O5=0,12.142=17,04g
=>Vkk=6.72.5=33,6l
nKClO3 = 24,5 : 122,5 = 0,2 (mol)
pthh : 2KClO3 -t--> 2KCl +3 O2
0,2---------------------> 0,3(MOL)
VO2 = 0,3 .22,4 = 6,72 (L)
pthh : 4P+5O2-t--> 2P2O 5
0,3---> 0,12 (mol)
=> mP2O5 = 0,12 . 142 = 17,04 (g)
ta co : Vkk = VO2:21% = 6,72 : 21% 32 (l)

nKClO3=0,1(mol)
PTHH: 2 KClO3 -to-> 2 KCl +3 O2
0,1_____________0,1______0,15(mol)
a) mKCl=0,1.74,5=7,45(g)
b) V(O2,đktc)=0,15.22,4=3,36(l)

a, PT: \(2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\)
Ta có: \(n_{KClO_3}=\dfrac{73,5}{122,5}=0,6\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,9\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,9.22,4=20,16\left(l\right)\)
b, PT: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
Ta có: \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{2}< \dfrac{0,9}{1}\), ta được O2 dư.
Theo PT: \(n_{MgO}=n_{Mg}=0,3\left(mol\right)\)
\(\Rightarrow m_{MgO}=0,3.40=12\left(g\right)\)
Bạn tham khảo nhé!

Đáp án B
n K C l O 3 = 12,25 122,5 = 0,1 m o l
2 K C l O 3 → 2 K C l + 3 O 2 0 , 1 → 0 , 15 m o l
V O 2 = 0 , 15 . 22 , 4 = 3 , 36 l

a) nKClO3 = 24,5/122,5 = 0,2 (mol)
PTHH: 2KClO3 -> (t°, MnO2) 2KCl + 3O2
Mol: 0,2 ---> 0,2 ---> 0,3
VO2 = 0,3 . 22,4 = 6,72 (l)
b) mKCl = 0,2 . 74,5 = 14,9 (g)
c) nZn = 13/65 = 0,2 (mol)
PTHH: 2Zn + O2 -> (t°) 2ZnO
LTL: 0,2/2 < 0,3 => O2 dư
nZnO = 0,2 (mol)
mZnO = 0,2 . 81 = 16,2 (g)

Ta có: \(n_{KClO_3}=\dfrac{49}{122,5}=0,4\left(mol\right)\)
PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
______0,4______0,4_____0,6 (mol)
\(\Rightarrow m_{KCl}=0,4.74,5=29,8\left(g\right)\)
\(V_{O_2}=0,6.22,4=13,44\left(l\right)\)

a, PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Ta có: \(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,3\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,3.24,79=7,437\left(g\right)\)
b, PT: \(2Cu+O_2\underrightarrow{t^o}2CuO\)
Ta có: \(n_{Cu}=\dfrac{32}{64}=0,5\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,5}{2}< \dfrac{0,3}{1}\), ta được O2 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{Cu}=0,25\left(mol\right)\\n_{CuO}=n_{Cu}=0,5\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,3-0,25=0,05\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\)
\(m_{CuO}=0,5.80=40\left(g\right)\)

\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ a,2Mg+O_2\rightarrow\left(t^o\right)2MgO\\ n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ b,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ n_{KClO_3}=\dfrac{0,05.2}{3}=\dfrac{1}{30}\left(mol\right)\\ \Rightarrow m_{KClO_3}=\dfrac{122,5}{30}=\dfrac{49}{12}\left(g\right)\)

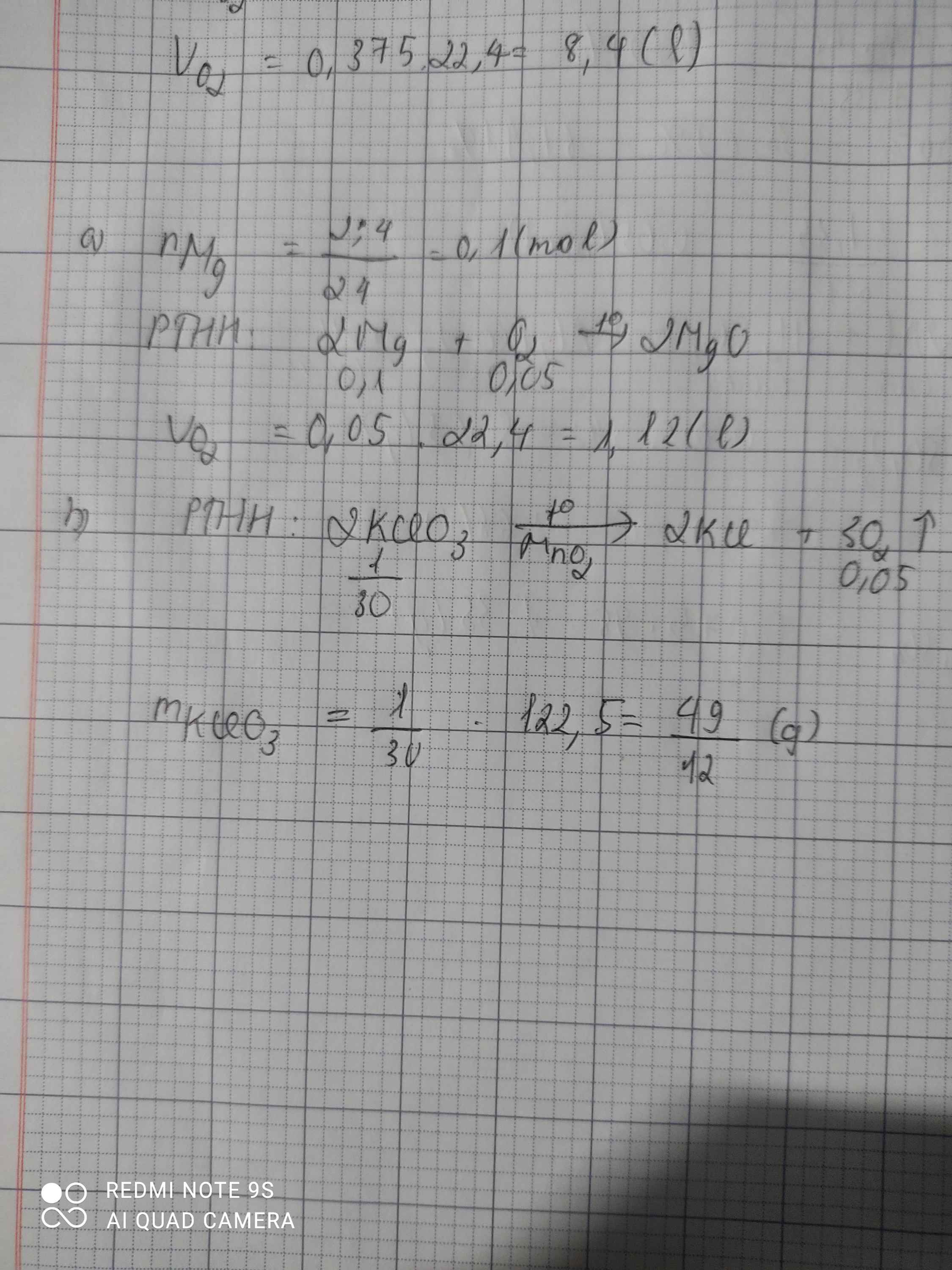

\(pthh:\)
\(2KMnO_4\overset{t^o}{--->}K_2MnO_4+MnO_2+O_2\uparrow\left(1\right)\)
\(2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\uparrow\left(2\right)\)
a. Ta có: \(n_{KMnO_4}=\dfrac{63,2}{158}=0,4\left(mol\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{1}{2}.0,4=0,2\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,2.22,4=4,48\left(lít\right)\)
b. Ta có: \(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,3.22,4=6,72\left(lít\right)\)
Tham khảo