
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a. \(CH_4\underrightarrow{t^0}CO_2+H_2O\)
-Chất tham gia: CH4 .
-Chất sản phẩm: CO2 , H2O.
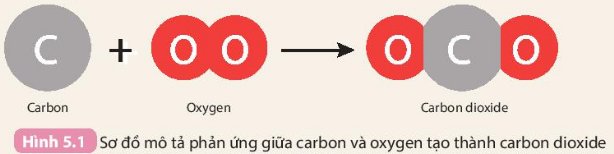
b. C + O2 \(\underrightarrow{t^0}\) CO2
- Chất tham gia: C và O2.
- Chất sản phẩm: CO2.

Vì C tạo 2 liên kết đôi với các nguyên tử O tạo thành hợp chất carbon dioxide (sp duy nhất), nên KL của carbon dioxide bằng tổng khối lượng carbon và oxygen.

a) Khí A có tỉ khối đối với H2 là: \(d_{A/H_2}=22\) nên khối lượng mol khí A bằng MA = 22.2 = 44 g/mol
b) Ta có công thức của khí A là XO2
Do MA = 44 nên MX + 2. 16 = 44 \(\rightarrow\) MX = 12
Vậy X là Carbon(C)
Công thức hoá học của phân tử khí A là CO2

a) Khối lượng mol của khí carbon dioxide (CO 2 ) bằng 12 + 16,2 = 44 (g/mol)
Tỷ lệ khối khí carbon dioxide (CO 2 ) đối với không khí bằng
dCO2/kk = MCO2/MKK = 44/29 = 1,52
Vậy khí carbon dioxide (CO2) nặng hơn không khí 1,52 lần
b) Trong lòng hang sâu thường xảy ra quá trình phân huỷ chất vô cơ hoặc hữu cơ, sinh ra khí carbon đioxide. Khí carbon đioxide tích tụ ở trên nền hang do khí đó nặng hơn không khí.
\(a,d_{\dfrac{CO_2}{KK}}=\dfrac{44}{29}\approx1,517\)
Vậy khí CO2 nặng hơn không khí và nặng gấp khoảng 1,517 lần
b, Trong lòng hang sâu thường xảy ra quá trình phân huỷ chất vô cơ hoặc hữu cơ, sinh ra khí carbon dioxide. Vì nặng hơn không khí khoảng 1,52 lần nên khí carbon dioxide tích tụ ở trên nền hang.

KL 1 mol phân tử iodine nặng hơn 1 mol phân tử nước
KL 1 mol phân tử nước nặng hơn 1 mol ng.tử carbon
Dựa vào thông tin Hình 3.1, ta thấy khối lượng của 1 mol nguyên tử cacbon < 1 mol phân tử nước < 1 mol chất phân tử.

`#3107.101107`
Khối lượng mol của \(\text{MgCO}_3\) là:
\(\text{M}_{\text{MgCO}_3}=24+12+16\cdot3=84\left(\text{mol}\right)\)
Số mol của \(\text{MgCO}_3\) là:
\(\text{n}_{\text{MgCO}_3}=\dfrac{\text{m}_{\text{MgCO}_3}}{\text{M}_{\text{MgCO}_3}}=\dfrac{16,8}{84}=0,2\left(\text{mol}\right)\)
PTHH: \(\text{MgCO}_3\text{ }\underrightarrow{t^0}\text{ CO}_2+\text{MgO}\)
Theo PT: 1 : 1 : 1 (mol)
`=>` n của MgO là `0,2` mol
Khối lượng của MgO thu được là:
\(\text{m}_{\text{MgO}}=\text{n}_{\text{MgO}}\cdot\text{ M}_{\text{MgO}_2}=0,2\cdot\left(24+16\right)=0,2\cdot40=8\left(\text{g}\right)\)
Hiệu suất của pứ trên là:
\(\text{H = }\dfrac{\text{m'}}{\text{m}}\cdot100=\dfrac{6}{8}\cdot100=75\%\)
Vậy, hiệu suất của phản ứng trên là `75%.`

`#3107.101107`
PTHH: \(\text{ C}+\text{O}_2\) \(\underrightarrow{\text{ }\text{ }\text{ }\text{ }\text{t}^0\text{ }\text{ }\text{ }}\) \(\text{CO}_2\)
Số mol của C là:
\(n_C=\dfrac{m_C}{M_C}=\dfrac{12}{12}=1\left(\text{mol}\right)\)
Theo PT: `1` mol C thu được 1 mol \(\text{CO}_2\)
Vậy, n \(\text{CO}_2\) là 1 mol
m của \(\text{CO}_2\) là:
\(\text{m}_{\text{CO}_2}=\text{n}_{\text{CO}_2}\cdot\text{M}_{\text{CO}_2}=1\cdot44=44\left(\text{g}\right)\)
Hiệu suất của phản ứng trên là:
\(\text{H}=\dfrac{\text{ m}'_{\text{CO}_2}}{\text{m}_{\text{CO}_2}}=\dfrac{39,6}{44}\cdot100=90\%\)

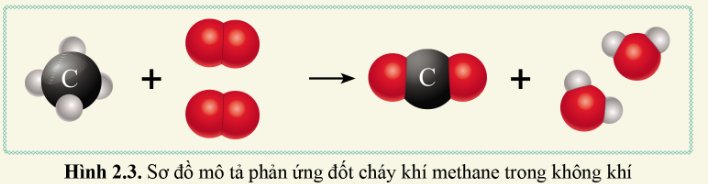
a. Trước phản ứng, có các chất là C, H, O.
- Những nguyên tử H đã liên kết với nguyên tử C, nguyên tử O liên kết với nguyên tử O.
b. Sau phản ứng, có các chất được tào thành là CO2, H2O.
- Những nguyên tử O đã liên kết với nguyên tử C, những nguyên tử H đã liên kết với những nguyên tử O.
c. Số nguyên tử C, H, O trước phản ứng và sau phản ứng đều bằng nhau



Khối lượng mol phân tử khí oxygen là: 16 × 2 = 32 (gam/ mol).
Khối lượng mol phân tử của khí carbon dioxide là: 12 + 16 x 2 = 44 (gam/mol)