
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Các chất ở cùng một ý thì đều tương tự nhau, nên mỗi ý cô viết 1 ví dụ nhé
a. MgCO3 → MgO + CO2
b. 2NaNO3 → 2NaNO2 + O2
c. 2Mg(NO3)2 → 2MgO + 4NO2 + O2

Cho hỗn hợp X tác dụng với H2SO4 loãng dư thì chỉ có Fe và Mg phản ứng; nên khối lượng CU là 1,28 gam
\(\text{ -> nCu=0,02 mol}\)
\(\text{Fe + H2SO4 -> FeSO4 + H2; Mg + H2SO4 -> MgSO4 + H2}\)
Gọi số mol Fe và Mg lần lượt là x, y -> nH2=x+y =1,456/22,4=0,065 mol
Cho X tác dụng với H2SO4 đặc nóng dư
\(\text{2Fe + 6 H2SO4 -> Fe2(SO4)3 + 3SO2 + 6H2O}\)
\(\text{Mg + 2H2SO4 -> MgSO4 + SO2 + H2O }\)
\(\text{Cu + 2H2SO4 -> CuSO4 + SO2 + H2O }\)
Theo ptpu: nSO2=3/2nFe+nMg+nCu=1,5x+y+0,02=0,105
\(\text{Giải được x=0,06; y=0,005}\)
\(\text{-> a=mFe+mCu +mMg=4,76 gam }\)
\(\Rightarrow\left\{{}\begin{matrix}\text{%Fe=70,59%}\\\text{ %Cu=26,89%}\\\text{%Mg=2,52%}\end{matrix}\right.\)

\(CH_3COOH+C_2H_5OH-^{t^o,H_2SO_4đặc}\rightarrow CH_3COOC_2H_5+H_2O\\ n_{CH_3COOH}=\dfrac{30}{60}=0,5\left(mol\right)\\ n_{CH_3COOC_2H_5\left(lt\right)}=n_{CH_3COOH}=0,5\left(mol\right)\\ \Rightarrow H=\dfrac{30}{0,5.88}.100=68,18\%\)

a) PTHH: \(Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+SO_2\uparrow\)
Ta có: \(n_{Na_2SO_3}=\dfrac{12,6}{126}=0,1\left(mol\right)=n_{SO_2}\) \(\Rightarrow V_{SO_2}=0,1\cdot22,4=2,24\left(l\right)\)
b) Ta có: \(\left\{{}\begin{matrix}n_{SO_2}=0,1\left(mol\right)\\n_{Ca\left(OH\right)_2}=1,4\cdot0,1=0,14\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo muối trung hòa
PTHH: \(Ca\left(OH\right)_2+SO_2\rightarrow CaSO_3\downarrow+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{CaSO_3}=0,1\left(mol\right)=n_{Ns_2SO_4}\\n_{Ca\left(OH\right)_2\left(dư\right)}=0,04\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{CaSO_3}=0,1\cdot120=12\left(g\right)\\m_{Na_2SO_4}=0,1\cdot142=14,2\left(g\right)\\m_{Ca\left(OH\right)_2\left(dư\right)}=0,04\cdot74=2,96\left(g\right)\end{matrix}\right.\)
\(n_{Na_2SO_3}=0,1\left(mol\right)\\ PTHH:Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+SO_2\)
(mol) 0,1 0,1 0,1 0,1
\(a.V_{SO_2}=0,1.22,4=2,24\left(l\right)\)
\(b.n_{Ca\left(OH\right)_2}=0,14\left(mol\right)\)
Do \(\dfrac{n_{OH}}{n_{SO_2}}=\dfrac{0,28}{0,1}=2.8>2\rightarrow\) Tạo muối trung hòa và Ca(OH)2 dư 0,04(mol)
\(PTHH:Ca\left(OH\right)_2+SO_2\rightarrow CaSO_3+H_2O\)
(mol) 0,1 0,1 0,1 0,1
\(m_{Ca\left(OH\right)_2\left(du\right)}=0,04.74=2,96\left(g\right)\\ m_{CaSO_3}=12\left(g\right)\\ m_{H_2O}=0,1.18=1,8\left(g\right)\)

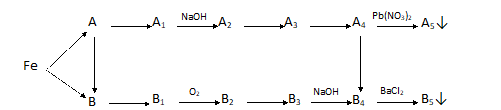

. Những phản ứng đặc trưng của các dẫn xuất hiđrocacbon:
1. Dẫn xuất halogen của hidrocacbon
Tuỳ thuộc vào gốc hidrocacbon mà ta sử dụng các thuốc thử cho thích hợp để phân biệt gốc hidrocacbon của chúng. Còn khi phải phân biệt hidrocacbon với chính dẫn xuất của nó ta có một số trường hợp đặc biệt sau:
a. Phân biệt ankan và dẫn xuất clo của ankan.
- Thuốc thử: đun trong dd NaOH
+ Hiện tượng: Khi cho AgNO3 vào sản phẩm thì có kết tủa
+ Phương trình: CnH2n+1Cl + NaOH → CnH2n+1OH + NaCl
NaCl + AgNO3 = NaNO3 + AgCl↓
b. Phân biệt anken và dẫn xuất hg của anken - Thuốc thử: thuỷ phân trong nước sôi
+ Hiện tượng: sản phẩm có axit làm đỏ giấy quỳ
+ Phương trình: RCH2=CH-CH2X + H2O --to--> RCH2=CH-CH2OH + HX
c. Phân biệt benzen và dẫn xuất clo của benzen - Thuốc thử: dd kiềm ở đk to, pc
+ Hiện tượng: Khi cho AgNO3 vào sản phẩm thì có kết tủa
2. Phenol - Thuốc thử 1: kim loại kiềm có khí thoát ra - Thuốc thử 2: ddNaOH
+ Hiện tượng: sp cho dung dd trong suất, khi sục CO2 thì dd có màu đục
+ Phương trình: C6H5OH + NaOH → C6H5ONa + H2O
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
3.Ancol
- Thuốc thử:kim loại kiềm(K,Na)
+ Hiện tượng:có khí bay ra
+ Phương trình:2ROH + 2Na → 2RONa+H2↑
a.Ancol bậc I
+ Thuốc thử:CuO đen,to
+ Hiện tương:Cu(đỏ), sản phầm sau pư tham gia pư tráng gương cho Ag
+ Phương trình:RCH2OH + CuO --to--> RCHO+Cu+H2O
RCHO+2[Ag(NH)3]OH→RCOONH4+2Ag↓+3NH3+ H2O
b.Ancol bậc II.
-Thuốc thử:CuO đen, to
+ Hiện tượng Cu đỏ),sản phầm sau pư không tham gia pư tráng gương
+Phương trình:RCH(OH)R' + CuO --to--> RCOR' + Cu + H2O
RCOR' không tham gia pư tráng gương
c.Ancol đa chức( etylglicol, glixerol và các ancol đa chức có 2 nhóm oh liền kề)
-Thuốc thử: Cu(OH)2
+Hiện tượng: dung dịch trong xanh màu lam.
+ Phương trình: 2C3H5(OH)3+Cu(OH)2→ [C3H5(OH)2O]2Cu + H2O
4.Anđehit RCHO
-Thuốc thử1: dung dịch AgNO3 trong NH3
+ Hiện tương:Tạo kết tủa Ag màu trắng
+ Phương trình: RCHO+2[Ag(NH3)2]OH --to--> RCOONH4+2Ag↓ +3NH3+H2O
hoặc viết RCHO+2AgNO3+3NH3+H2O --to--> RCOONH4+2Ag↓ + 2NH4NO3
-Thuốc thử 2:Cu(OH)2 trong NaOH
+ Hiện tương:Tạo kết tủa màu đỏ Cu2O
+ Phương trình:RCHO+2Cu(OH)2 + NaOH --to--> RCOONa + Cu2O↓+ 3H2O
chú ý: HCOOH+2Cu(OH)2+2NaOH --to--> Na2CO3+Cu2O↓ +4H_2O
5. Axit cacboxylic
-Thuốc thử:Giấy quỳ tím
+ Hiện tương: giấy quỳ hoá đỏ
-Thuốc thử 2: CaCO3 hoặc Na2CO3
+ Hiện tượng:có khí CO2 bay lên
+ Phương trình: 2RCOOH+ Na2CO3→2RCOONa + CO2↑+H2O
2RCOOH + CaCO3→ (RCOO)2Ca+CO2 ↑+H2O.