Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Gọi V, V’ lần lượt là thể tích dung dịch NaOH có pH = 12, pH = 11
Do pH = 12 => pOH = 2 => [OH-] = 10-2M => nOH-trước khi pha loãng = 10-2V
pH = 11 => pOH = 3 => [OH-] = 10-3M => nOH-sau khi pha loãng = 10-3V’
Ta có nOH-trước khi pha loãng = nOH-sau khi pha loãng => 10-2V = 10-3V’
![]()
Vậy cần pha loãng dung dịch NaOH 10 lần

Chọn C.
Pha loãng hay cô cạn dung dịch thì số mol chất tan không đổi, thể tích thay đổi nên nồng độ mol thay đổi, pH thay đổi.
Gọi Vl, V2 là thể tích dung dịch axit có pH = 3 và thể tích H2O cần dùng để pha loãng.
- p H = 3 ⇒ H + = 10 - 3 M ⇒ s ố m o l H + = 10 - 3 V 1
- p H = 4 ⇒ H + = 10 - 4 M ⇒ s ố m o l H + = 10 - 4 V 1 + V 2
- Số mol H+ trước = số mol H+ sau ⇒ 10 - 3 V 1 = 10 - 4 V 1 + V 2 ⇒ 9 V 1 = V 2
Vậy phải hòa 1 thể tích axit với 9 phần thể tích H2O.

Đáp án B
Gọi V, V’ lần lượt là thể tích dung dịch HCl có pH = 3, pH = 4
Do pH = 3 => [H+] = 10-3M => nH+trước khi pha loãng = 10-3V
pH = 4 => [H+] = 10-4M => nH+sau khi pha loãng = 10-4V’
Ta có nH+trước khi pha loãng = nH+sau khi pha loãng=> 10-3V = 10-4V’
=> V ' V = 10 - 3 10 - 4 = 10
Vậy cần pha loãng axit 10 lần

Chọn B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
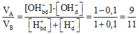

Đáp án B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
VA/VB = (1-0,1)/(1+0,1) = 9/11

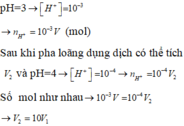


Chọn B
1013-11 = 100