Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Nếu Mg dư, S dư hay cả hai cùng dư thì tất cả các chất sau phản ứng đều là chất rắn. Về nguyên tắc của định luật bảo toàn khối lượng thì tổng khối lượng của nó sẽ bằng tổng khối lượng các chất trước phản ứng, mặc dù ta không cần biết sau phản ứng chứa những chất nào và với lượng là bao nhiêu.
Bảo toàn khối lượng
mRắn = mMg + mS = 4,8 + 3,2 = 8,0 gam.

n Zn = 0,65/65 = 0,01 mol; n S = 0,224/32 = 0,007 mol
Zn + S → ZnS (1)
Theo (1) sau phản ứng trong ống nghiệm thu được:
n ZnS = 0,007 mol
m ZnS = 0,007x97 = 0,679 (g)
n Zn dư = (0,01 - 0,007) = 0,003 mol
m Zn dư = 65.0,003 = 0,195g

nFe = 0,1 mol
nS = 0,05 mol
PTHH : Fe + S --to--> FeS
a. Vì nFe > nS nên Fe dư sau phản ứng . A gồm FeS là Fe dư
b. Theo PT Trên , nFeS = nFe phản ứng = nS = 0,05 mol
có nFe dư = nFe ban đầu - nFe phản ứng = 0,1 -0,05 = 0,05 mol
⇒ mA = mFeS + mFe dư = 0,05.88 + 0,05.56 = 7,2 gam
Câu 2 :
nAl = 0,3 mol
nS = 0,3 mol
PTHH : 2Al + 3S --to--> Al2S3
a. Vì nAl .3/2 > nS nên Al dư . A gồm Al2O3 và Al dư
nAl phản ứng = 2/3 .nS = 0,2 mol
nAl2S3 =nS .1/3 =0,1 mol
có nAl dư = nAl ban đầu - nAl phản ứng = 0,3 -0,2 = 0,1 mol
⇒ mA = mAl2S3 + mAl dư = 0,1.150 + 0,1.27 = 17,7 gam

a)
$n_{Zn} = 0,01(mol) ; n_{S} =0,007(mol)$
$Zn + S \xrightarrow{t^o} ZnS$
$n_{Zn} > n_S$ nên Zn dư
$n_{ZnS} = n_{Zn\ pư} = n_S = 0,007(mol)
Sau phản ứng :
$m_{ZnS} = 0,007.97 = 0,679(gam)$
$m_{Zn\ dư} = (0,01 - 0,007).65 = 0,195(gam)$
b)
2Zn + O2 \(\xrightarrow{t^o}\) 2ZnO
0,01.................0,01........(mol)
S + O2 \(\xrightarrow{t^o}\) SO2
0,007................0,007..............(mol)
Sau phản ứng :
$m_{ZnO} = 0,01.81 = 0,81(gam)$
$m_{SO_2} = 0,007.64 = 0,448(gam)$

\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
Do khi hòa tan A vào HCl thu được hỗn hợp khí
=> Trong A chứa H2, H2S
=> Al dư, S hết
PTHH: 2Al + 3S --to--> Al2S3
0,2<--0,3------>0,1
2Al + 6HCl --> 2AlCl3 + 3H2
0,1----------------------->0,15
Al2S3 + 6HCl --> 2AlCl3 + 3H2S
0,1------------------------>0,3
=> \(\overline{M}_X=\dfrac{0,15.2+0,3.34}{0,15+0,3}=\dfrac{70}{3}\left(g/mol\right)\)
=> \(d_{X/H_2}=\dfrac{\dfrac{70}{3}}{2}=\dfrac{35}{3}\)

n\(_{Fe}\)=\(\dfrac{10}{56}\)\(\simeq\)0,19(mol)
n\(_S\)=\(\dfrac{4,8}{32}\)=0,15(mol)
Fe+S\(\rightarrow\)FeS
ban đầu: 0,19 0,15 (mol)
phản ứng: 0,15 0,15 0,15(mol)
dư: 0,04 0 0 (mol)
m\(_{FeS}\)=0,15.88=13,2(g)
vì H=70% nên:
m\(_{FeS}\)=\(\dfrac{13,2.70}{100}\)=9,24(g)
m\(_{Fe\left(dư\right)}\)=0,04.56=2,24(g)

Đáp án B
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol), nS = 0,15 9mol)
nH2S = nMgS = nS = 0,15 mol;
nH2 = nMg (dư) = 0,2 – 0,15 =0,05 (mol)
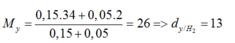

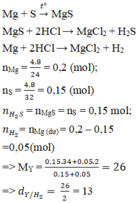

Đáp án A.
nMg = 0,2 (mol), nS = 0,1 (mol)
Mg + S → MgS
0,2 0,1 0,1 (mol) , Mg dư
mCr = mMgS + mMg = 0,1. (24+32) + 0,1.24 = 8g