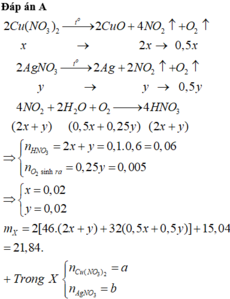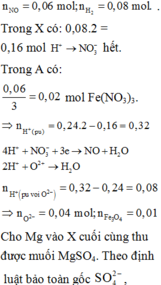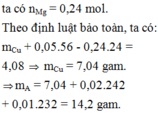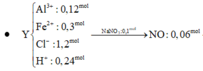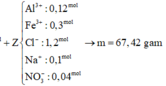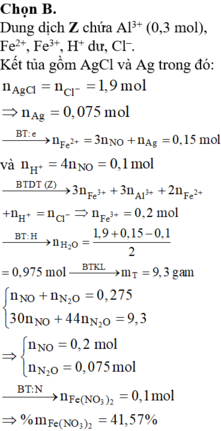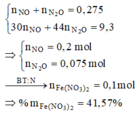Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
P1: + NaOH → H2 → có Al dư → n A l = 2 3 n H 2 = 0 , 09 m o l
P2: Bảo toàn e: 2 n C u + n A g + 3 n A l = 3 n N O → 2 n C u + n A g = 0 , 021 m o l
Lại có: 64 n C u + 108 n A g + 27 n A l = 3 , 33 g → 64 n C u + 108 n A g = 0 , 9 g
→ n C u = 0 , 009 ; y = 0 , 003 m o l
Trong 6,66g B có: 0,018 mol Cu ; 0,006 mol Ag ; 0,18 mol Al
Dung dịch C + HCl không tạo kết tủa → không có Ag+
+) Dung dịch D + thanh Fe:
m g i ả m = m F e p ư - m C u r a = 56 ( n F e ( a x ) + n F e ( C u 2 + ) ) - 64 n C u 2 +
Lại có: n F e ( a x ) = n H 2 = 0 , 04 m o l → n C u 2 + = 0 , 012 m o l
Bảo toàn nguyên tố:
n A g 2 S O 4 = 1 / 2 n A g ( B ) = 0 , 003 m o l ; n C u S O 4 = n C u ( B ) + n C u ( C ) 2 + = 0 , 015 m o l
→ m A g 2 S O 4 ( X ) = 16 , 32 %

Chọn C
2Cu(NO3)2 → t ° 2CuO + 4NO2↑+ O2↑ (1)
2x →4x → x (mol)
4Fe(NO3)2 → t ° 2Fe2O3 + 8NO2↑ + O2↑ (2)
4y → 8y → y (mol)
4NO2 + O2 + 2H2O → 4HNO3 (3)
Ta thấy ở PTHH (1) và (3): nNO2: nO2 = 4: 1
ở PTHH (2) nNO2 : nO2 = 8 : 1
=> số khí thoát ra chính là khí NO2 dư ở PTHH (2)
=> nNO2 = 0,448 : 22,4 = 0,02 (mol)
=> 4y = 0,02 => y = 0,005 (mol)
BTKL: mhh = 188.2x + 180.4y = 20,2
=> x= 0,044 (mol)
=> nHNO3 = 2nCu(NO3)2 + 2nFe(NO3)2 – nNO2 dư = 2. 2.0,044 + 2. 4.0,005 – 0,02 = 0,196 (mol)
=> CM HNO3 = 0,196 : 2 = 0,098 (M)
=> pH = -log [HNO3] = 1

Chọn A
nH+ = 12nN2 + 10nNH4+ + 2nO (oxit) ⇒ nNH4+ = 0,05
Trong dung dịch Y có a mol Mg2+; b mol Fe3+; c mol Fe2+
⇒ nKOH = 2a + 3b + 2c + nNH4+ = 3,15 ⇒ 2a + 3b + 2c = 3,1 (1)
Sau khi tác dụng với KOH thì phần dung dịch chứa 3,15 mol K+; 1,54 mol SO42- và nNO3- = 0,07
Bảo toàn N ⇒ nNO3- ban đầu = 2nN2 + nNH4+ + nNO3- (trong Y) = 0,2
⇒ mX = 24a + 56(b + c) + 62.0,2 + 1,05.16 = 86 (2)
Bảo toàn ne ⇒ 3nAl phản ứng = 3nFe3+ + 2nFe2+ ⇒ nAl phản ứng = b + 2c/3
⇒ mtăng = 56(b + c) – 27(b + 2c/3) = 28 (3)
(1), (2), (3) ⇒ a = 0,15; b = 0,9; c = 0,05
Oxit thu được gồm MgO (0,15 mol) và Fe2O3 (0,95/2 = 0,475) ⇒ m = 0,15.40 + 0,475.160 = 82

Chọn đáp án C.
Quy đổi hỗn hợp tương đương với hỗn hợp gồm a mol Fe, b mol OH và c mol O.
Khí Z gồm H2 và NO.
n t h a n h F e p ư = 11 , 76 56 = 0 , 21 m o l
Dung dịch cuối cùng chứa Fe2+, Na+, S O 4 2 -
→ B T N T 2 a + 2 . 0 , 21 + 0 , 96 = 2 . 0 , 96
⇒ a = 0 , 27
⇒ n H 2 = 0 , 03 m o l n N O = 0 , 03 m o l → B T N T N x = 0 , 13 m o l