Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Để tính V, ta sẽ sử dụng công thức nồng độ (C) và thể tích (V) của dung dịch. Ta có thể sử dụng công thức sau:
C1V1 = C2V2
Trong đó:
C1 là nồng độ của dung dịch CuSO4 ban đầu (1M)V1 là thể tích của dung dịch CuSO4 ban đầu (chưa có kẽm) (chưa biết)C2 là nồng độ của dung dịch CuSO4 sau khi kẽm không tan được nữa (1M)V2 là thể tích của dung dịch CuSO4 sau khi kẽm không tan được nữa (chưa biết)Ta cũng biết rằng khối lượng của lá kẽm sau khi rửa và làm khô là 52,92g.
Từ đó, ta có thể tính được thể tích của dung dịch CuSO4 ban đầu (V1) như sau:
V1 = (C2V2) / C1
Với C2 = 1M và C1 = 1M, ta có:
V1 = V2
Vậy, thể tích của dung dịch CuSO4 ban đầu (V1) cũng chính là thể tích của dung dịch CuSO4 sau khi kẽm không tan được nữa (V2).
Tuy nhiên, từ đề bài không cung cấp thông tin về thể tích của dung dịch CuSO4 sau khi kẽm không tan được nữa (V2), nên không thể tính được thể tích của dung dịch CuSO4 ban đầu (V1).

Đáp án B
Số mol H2 thu được là: n H 2 = 0 , 3 mol
Đặt số mol các chất trong X là Zn: a mol ; Fe: b mol.
m Zn + m Fe = m X ⇒ 65 a + 56 b = 18 , 6 ( I )
Sơ đồ phản ứng:
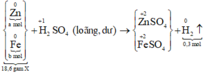
Các quá trình nhường, nhận electron:
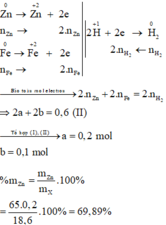

a) rZn = 1,35. 10-1 nm = 0,135.10-7 cm (1nm = 10-9m)
1u = 1,6600.10-24 g.
mZn = 65.1,6600.10-24 g = 107,9.10-24g.
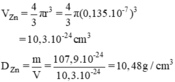
b) mhạt nhân Zn = 65u ⇒ 107,9.10-24 gam.
rhạt nhân Zn = 2.10-6nm = (2.10-6.10-7)cm = 2.10-13 cm.
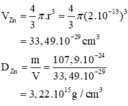

r = 1,38\(A^0\)= 1,38 . \(10^{-8}\)cm
a) Khối lượng riêng của kẽm :
\(r=\sqrt[3]{\dfrac{3Ma}{4\pi DN}}\)
⇔ 1,38 . \(10^{-8}\)= \(\sqrt[3]{\dfrac{3.65.100\%}{4.\pi.D.6,023.10^{23}}}\)
⇔ \(\left(1,38.10^{-8}\right)^3\) = \(\dfrac{3.65.100\%}{4.\pi.D.6,023.10^{23}}\)
⇔ D ≃ 9,803 (g/\(cm^3\))
Vậy khối lượng riêng của kẽm là 9,803g/\(cm^3\)
b) Khối lượng riêng đúng của kẽm :
\(D_{thực}=D.\dfrac{72,5}{100}\)= 9,803 . \(\dfrac{72,5}{100}\)≃ 7,107 (g/\(cm^3\))

a)
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
b) Gọi số mol Zn và Fe có trong 17,7 gam hỗn hợp là x và y mol. nH2 = \(\dfrac{6,72}{22,4}\)=0,3 mol
Theo tỉ lệ phản ứng ta có \(\left\{{}\begin{matrix}x+y=0,3\\65x+56y=17,7\end{matrix}\right.\)=> x = 0,1 và y = 0,2
=> mZn = 0,1.65 = 6,5 gam và mFe= 0,2.56 = 11,2 gam
c) nHCl = 2nH2 = 0,3.2 = 0,6 mol
Áp dụng ĐLBT khối lượng => m muối clorua = mKl + mHCl - mH2
<=> m muối = 17,7 + 0,6.36,5 - 0,3.2 = 28,05 gam

n AgNO 3 = 0,1 x 0,1 = 0,01 mol
Zn + 2 AgNO 3 → Zn NO 3 2 + 2Ag
m Ag = 0,01 x 108 = 1,08g
m Zn = 65 x 0,005 = 0,325g


