Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
PTHH: 2Al + 3CuSO4 --> Al2(SO4)3 + 3Cu
______a--------------------------------->1,5a
=> 5 - 27a + 64.1,5a = 5,69
=> a = 0,01
=> nCu = 0,015(mol)
=> mCu = 0,015.64 = 0,96 (g)
b) nCuSO4 = 0,25.0,4 = 0,1 (mol)
PTHH: 2Al + 3CuSO4 --> Al2(SO4)3 + 3Cu
____0,01--->0,015------->0,005
=> \(\left\{{}\begin{matrix}C_M\left(Al_2\left(SO_4\right)_3\right)=\dfrac{0,005}{0,25}=0,02M\\C_M\left(CuSO_4\right)=\dfrac{0,1-0,015}{0,25}=0,34M\end{matrix}\right.\)

Cu → 2Ag
1 2 → mtang = 2.108-64 = 152g
x 2x → mtang = =1,52g
⇒ x = 1,52/152 = 0,01 mol
⇒ n A g N O 3 = n A g = 2x = 0,02 mol
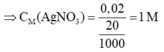
⇒ Chọn C.

\(a,\) Đặt \(n_{CuSO_4}=x(mol)\)
\(PTHH:2Al+3CuSO_4\to Al_2(SO_4)_3+3Cu\\ \dfrac{2}{3}x.....x......\dfrac{1}{3}x.....x(mol)\\ \Rightarrow \Delta m_{Al\uparrow}=m_{Cu}-m_{Al}=64x-\dfrac{2}{3}.27x=1,38\\ \Rightarrow x=0,03\\ \Rightarrow m_{Cu}=0,03.64=1,92(g)\\ b,n_{CuSO_4}=0,03(mol)\\ \Rightarrow C_{M_{CuSO_4}}=\dfrac{0,03}{0,2}=0,15M\)
Gọi khối lượng Al ban đầu là a gam
khối lượng Al pư là x gam
PTHH: 2Al+3CuSO4→Al2(SO4)3+3Cu
a, vì khối lượng của nhôm sau pư tăng 1,38g, nên ta có PT:
(a-x) + 192x/54 = a + 1,38
⇒ x= 0,54
⇒ a= 0,54 + 1,38 = 1,92g
b, nAl=0,54/27 = 0,02 mol
theo PTHH có nCuSO4=2/3 .nAl = 0,03 mol
⇒CMCuSO4=0,03/0,2=0,15M
Chúc bạn học tốt nha!

a) \(m_{tăng}=32,85-16,2=16,65\left(g\right)\\3 CuSO_4+2Al\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
Gọi x là số mol Al phản ứng
=> \(n_{Cu}=\dfrac{3}{2}n_{Al}=1,5x\left(mol\right)\)
Ta có: \(m_{tăng}=1,5x.64-27x=16,65\left(g\right)\)
=> \(x=\dfrac{111}{460}\left(mol\right)\)
=> \(m_{Al\left(pứ\right)}=\dfrac{111}{460}.27=6,52\left(g\right)\); \(m_{Cu}=\dfrac{111}{460}.1,5.64=23,17\left(g\right)\)
b) \(m_{ddsaupu}=6,52+512-23,17=495,35\left(g\right)\)
\(n_{CuSO_4\left(pư\right)}=\dfrac{512.25\%}{160}=0,8\left(mol\right)\)
=> \(n_{CuSO_4\left(dư\right)}=0,8-\dfrac{111}{460}.1,5=\dfrac{403}{920}\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=\dfrac{111}{920}\left(mol\right)\)
=> \(C\%_{CuSO_4}=14,15\%;C_{Al_2\left(SO_4\right)_3}=8,33\%\)



a)
Gọi số mol CuCl2 phản ứng là a (mol)
PTHH: 2Al + 3CuCl2 --> 2AlCl3 + 3Cu
____\(\dfrac{2}{3}a\)<-----a--------------------->a
=> \(20-\dfrac{2}{3}a.27+64a=33,8\)
=> a = 0,3 (mol)
=> mCu = 0,3.64 = 19,2(g)
b)
\(C_{M\left(ddCuCl_2\right)}=\dfrac{0,3}{0,15}=2M\)