Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Theo ĐLBT ĐT thì 0,2.1+ 2x+ 0,3=0,7 suy ra x=0,1 mol
AgNO3→ Ag+ NO2+ ½ O2
Cu(NO3)2 →CuO+ 2NO2+ ½ O2
KNO3 →KNO2+ ½ O2
Chất rắn Y chứa Ag: 0,2 mol; CuO: 0,1 mol; KNO2: 0,3 mol
m=0,2.108+ 0,1.80+ 0,3.85=55,1 gam

Đáp án B
Ta thấy dung dịch tồn tại hỗn hợp 2 axit HNO3 và H2SO4
Vì H2SO4 là một axit khó bay hơi
Mặt khác khi cô cạn dung dịch muối cũng không bay hơi
Do đó chất bị bay hơi chỉ có thể là HNO3



Đáp án D
BTĐT: nNO3- = nNa+ + 2nBa2+ + 2nMg2+ - nCl- = 0,3.1+0,1.2+0,05.2-0,2.1=0,4 mol
m muối = mNa+ + mBa2+ + mMg2+ + mCl- + mNO3- = 0,3.23+0,1.137+0,05.24+0,2.35,5+0,4.62 = 53,7 gam

Đáp án C
n Al 3+ + 2 n Fe 2+ + n Na+ = 2 n SO4 2- + n Cl-
=> 2a + b = 0.8 (1)
m muối = m Al 3++ m Fe 2+ + m Na+ + m SO4 2- + m Cl- = 51,6 g
=> 96 a + 35,5 b = 35 ,9 g (2)
Giải (1) và (2 ) ta có a = 0,3 , b = 0,2

Đáp án D
Để dung dịch tồn tại thì ion Y2- là SO42-
Theo định luật bảo toàn điện tích: 0,1.1+ 0,2.2+0,1.1=0,2+ 2a
Suy ra a= 0,2
Muối khan thu được là: 0,1.39+ 0,2.24+ 0,1.23+0,2.35,5+ 0,2.96= 37,3 gam

Quan sát 4 đáp án ta thấy
![]()
Vì dung dịch tồn tại 0,2 mol Mg2+ mà MgCO3 là chất kết tủa do đó Y sẽ là ![]() . Áp dụng định luật bảo toàn điện tích ta có
. Áp dụng định luật bảo toàn điện tích ta có
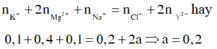
Khối lượng muối bằng tổng khối lượng của các ion trong dung dịch:
![]() gam
gam
Đáp án B.

Đáp án B
-Cho ½ dung dịch X phản ứng với dung dịch NaOH dư
HCO3-+ OH- →CO32-+ H2O
Ca2++ CO32- dư →CaCO3
0,02 0,02
- Cho ½ dung dịch X phản ứng với dung dịch Ca(OH)2 dư
HCO3-+ OH- →CO32-+ H2O
0,045 0,045
Ca2++ CO32- →CaCO3
0,045 0,045
Dung dịch X có 0,07 mol Cl-; 0,04 mol Ca2+; 0,09 mol HCO3-; 0,08 mol Na+
Đun sôi dung dịch X thì: 2HCO3- → CO32-+ H2O + CO2
0,09 0,045 0,045 0,045
m = (0,07.35,5+0,04.40+ 0,09.61+ 0,08.23-0,045.18-0,045.44) = 8,625 gam

Đáp án D
Biện luận : Vì X tác dụng với HCl hoặc NaOH đun nóng đều thấy thoát khí, suy ra X là hỗn hợp muối amoni của amin hoặc của NH3 với axit cacbonic. C2H7O3N chỉ có 1 nguyên tử N nên chỉ có một gốc amoni, vậy công thức cấu tạo của nó là CH3NH3HCO3; C2H10O3N2 có 2 nguyên tử N nên có 2 gốc amoni, suy ra công thức cấu tạo của nó là CH3NH3CO3H4N.
Theo bảo toàn gốc cacbonat và nguyên tố K, ta có
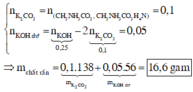

Đáp án D
Gọi số mol của ancol A là: x(mol)
Gọi tổng số mol của axit cacboxylic B và este C là : y (mol)
Đốt cháy B, C luôn cho nH2O = nCO2
Đốt cháy A cho nH2O > nCO2 và có x = nH2O – nCO2
=> nH2O = x + 0,14
BTNT O: x + 2y + 0,18.2 = 0,14.2 + ( 0,14 + x)
=> y = 0,03 (mol)
nNaOH pư = n(B+C) = 0,03 (mol) => nNaOH dư = 0,02 (mol)
=> 0,03 (RCOONa) + 0,02. NaOH = 3,26 (g)
=> 0,03 ( R + 67) + 0,02. 40 = 3,26
=> R = 15
Vậy rắn Y: CH3COONa: 0,03 mol và NaOH: 0,02 (mol)
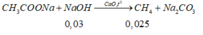
=> nCH4 = nNaOH = 0,025 (mol) => mCH4= 0,025. 16 = 0,4(g)
=> gần nhất với Đáp án D là 4,1 g


Đáp án D
Áp dụng định luật bào toàn điện tích cho dung dịch ban đầu ta có
Khi cô cạn dung dịch thì có phản ứng sau xảy ra
Sau khi dung dịch đã bay hơi hết nước và cô cạn chất rắn tới khối lượng lượng không đổi, nên có phản ứng sau:
Chú ý: Cách viết phương trình trên không đúng với bản chất hóa học do chất rắn không thể viết được dưới dạng ion nhưng ta có thể viết để có thể đơn giản cách giải trở nên nhanh chóng trong các bài tập trắc nghiệm.
Tuy nhiên các bạn cũng cần lưu ý rằng muối cacbonat của kim loại kiềm không bị nhiệt phân nên lượng muối cacbonat bị nhiệt phần chỉ tương ứng với ion Ca2+ (muối CaCO3) nên nếu thì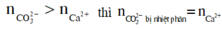
còn lại vẫn tồn tại dưới dạng muối cacbonat của kim loại kiềm. Do vậy nếu không nắm chắc bản chất phản ứng, các bạn vẫn nên viết phản ứng nhiệt phân muối cacbonat dạng phân tử:
Do đó khối lượng chất rắn thu được cuối cùng là tổng khối lượng của 0,1 mol CaO và 0,2 mol NaCl.
Vậy khối lượng của chất rắn là
m = 0,1.56+0,2.58,5 = 17,3 (gam)