Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
b) \(n_{H_2SO_4}=\dfrac{m_{H_2SO_4}}{M_{H_2SO_4}}=\dfrac{49}{98}=0,5\left(mol\right)\)
Theo PTHH ta thấy:
\(\dfrac{n_{Zn}}{1}=\dfrac{0,2}{1}\)
\(\dfrac{n_{H_2SO_4}}{1}=\dfrac{0,5}{1}\)
\(\Rightarrow\dfrac{n_{Zn}}{1}< \dfrac{n_{H_2SO_4}}{1}\)
Vậy axit sunfuric dư
c) Theo PTHH: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=n_{H_2}.22,4=0,2.22,4=4,48\)
a)\(PTHH:Zn+H_{ 2}SO_4\xrightarrow[]{}ZnSO_4+H_2\)
b)\(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(m\right)\)
\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
tỉ lệ :1 1 1 1
số mol bđ :0,2 0,5
ta có tỉ lệ : \(\dfrac{0,2}{1}< \dfrac{0,5}{1}=>H_2SO_4\) \(dư\)
vậy sau phản ứng \(H_2SO_4\) \(dư\)
c)\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
tỉ lệ :1 1 1 1
số mol :0,2 0,2 0,2 0,2
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)

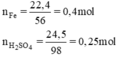
Phương trình hóa học của phản ứng:

So sánh tỉ lệ 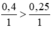 ⇒ Fe dư
⇒ Fe dư
Theo PT nFe (pư) = nH2SO4 = 0,25 mol ⇒ nFe dư = 0,4 – 0,25 = 0,15 mol
mFe dư = 0,15. 56 = 8,4g.
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4.
nH2 = nH2SO4 = 0,25 mol
Vkhí = 0,25 . 22,4 = 5,6l.

a) nFe=0,4(mol); nH2SO4=0,5(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
Ta có: 0,4/1 < 0,5/1
=> Fe hết, H2SO4 dư. tính theo nFe.
=> nH2= nH2SO4(p.ứ)=nFe=0,4(mol)
=>nH2SO4(dư)=0,5-0,4=0,1(mol)
=>H2SO4(dư)=0,1.98=9,8(g)
b) V(H2,dktc)=0,4.22,4=8,96(l)

a)
\(Zn + 2HCl \to ZnCl_2 + H_2\)
b)
\(n_{Zn} = \dfrac{13}{65} = 0,2(mol)\)
Ta thấy : \(\dfrac{n_{Zn}}{1} = 0,2 > \dfrac{n_{HCl}}{2} = 0,15\) nên Zn dư.
Theo PTHH :
\(n_{Zn\ pư} = 0,5n_{HCl} = 0,15(mol)\\ \Rightarrow n_{Zn\ dư} = 0,2 - 0,15 = 0,05(mol)\\ \Rightarrow m_{Zn\ dư} = 0,05.65 = 3,25(gam)\)
c)
Ta có :
\(n_{H_2} = n_{Zn\ pư} = 0,15(mol)\\ \Rightarrow V_{H_2} = 0,15.22,4 = 3,36(lít)\)

a) PTHH: 2Al + 6HCl -> 2AlCl3 + 3 H2
b) nHCl=0,6(mol); nAl=0,3(mol)
Ta có: 0,3/2 > 0,6/6
=> HCl hết, Al dư, tính theo nHCl
c) nH2= 3/6 . nHCl=3/6 . 0,6= 0,3(mol)
=> V=V(H2,đktc)=0,3.22,4= 6,72(l)

PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,2\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\\m_{H_2SO_4\left(dư\right)}=0,3\cdot98=29,4\left(g\right)\end{matrix}\right.\)
nH2SO4=0,5(mol)
nZn=0,2(mol)
a) PTHH: Zn + H2SO4 -> ZnSO4 + H2
ta có: 0,5/1 > 0,2/1
=> Zn hết, H2SO4 dư, tính theo nZn
b) m(H2SO4 dư)= (0,5-0,2).98=29,4(g)
c) nH2= nZn=0,2(mol)
=>V(H2,đktc)=0,2.22,4=4,48(l)

Số mol của kẽm
nZn = \(\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
Pt : Zn + 2HCl → ZnCl2 + H2\(|\)
1 2 1 1
0,3 0,4 0,2 0,2
a) Lập tỉ số só sánh : \(\dfrac{0,3}{1}>\dfrac{0,4}{2}\)
⇒ Zn dư , HCl phản ứng hết
⇒ Tính toán dựa vào số mol của HCl
Số mol dư của kẽm
ndư = nban đầu - nmol
= 0,3 - (\(\dfrac{0,4.1}{2}\))
= 0,1 (mol)
Khối lượng dư của kẽm
mdư = ndư . MZn
= 0,1 . 65
= 6,5 (g)
b) Số mol của khí hidro
nH2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,2 . 22,4
= 4,48 (l)
Số mol của muối kẽm clorua
nZnCl2 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của muối kẽm clorua
mznCl2 = nZnCl2 . MZnCl2
= 0,2. 136
= 27,2 (g)
c) 4H2 + Fe3O4 → (to) 3Fe + 4H2O\(|\)
4 1 3 4
0,2 0,15
Số mol của sắt
nFe = \(\dfrac{0,2.3}{4}=0,15\left(mol\right)\)
Khối lượng của sắt
mFe = nFe. MFe
= 0,15 . 56
= 8,4 (g)
Chúc bạn học tốt

a. PTHH :Fe + H2SO4 -> FeSO4 +H2
nFe = 22,4 : 56 = 0,4 (mol)
nH2SO4 = 24,5 : 98 = 0,25 (mol)
Ta có nFe > nH2SO4 (0,4>0,25) nên Fe dư
nFe dư = 0,4-0,25 = 0,15 (mol)
Vậy mFe dư = 0,15 . 56 = 8,4 (gam)
b, Theo PTHH ta có nH2 = nH2SO4 =0,25 (mol)
=> VH2 thu được (đktc) =0,25 . 22,4 =5,6(lit)
Ta có: \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\\ n_{H_2SO_4\left(loãng\right)}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
PTHH: Fe + H2SO4 (loãng) -> FeSO4 + H2\(\uparrow\)
Theo PTHH và đề bài, ta có:
\(\dfrac{n_{Fe\left(đềbài\right)}}{n_{Fe\left(PTHH\right)}}=\dfrac{0,4}{1}>\dfrac{n_{H_2SO_4\left(loãng,đềbài\right)}}{n_{H_2SO_4\left(loãng,PTHH\right)}}=\dfrac{0,25}{1}\)
=> H2SO4 loãng hết, Fe dư nên tính theo \(n_{H_2SO_4\left(loãng\right)}\)
Theo PTHH và đề bài, ta có:
\(n_{H_2}=n_{Fe\left(phảnứng\right)}=n_{H_2SO_4\left(loãng\right)}=0,25\left(mol\right)\\ =>n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
a) Khối lượng Fe dư:
\(m_{Fe\left(dư\right)}=0,15.56=8,4\left(g\right)\)
b) Thể tích khí H2 thu được (ở đktc):
\(V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\)



\(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\\ pthh:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ LTL:\dfrac{0,2}{1}< \dfrac{0,5}{1}\)
=> H2SO4 dư
\(n_{H_2}=n_{Zn}=0,2\left(mol\right)\\ V_{H_2}=0,2.22,4=4,48\left(l\right)\)
`a)PTHH:`
`Zn + H_2 SO_4 -> ZnSO_4 + H_2`
`0,2` `0,2` `0,2` `(mol)`
`b)n_[H_2 SO_4]=49/98=0,5(mol)`
Ta có:`[0,2]/1 < [0,5]/1`
`=>H_2 SO_4` dư
`c)V_[H_2]=0,2.22,4=4,48(l)`