Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Coi V = 22,4(lít)
Thí nghiệm 1 : $Al$ dư
$n_{H_2} = 1(mol)$
Gọi $n_{Na} = a(mol)$
$2Na + 2H_2O \to 2NaOH + H_2$
$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
Theo PTHH :
$n_{H_2} = 0,5a + 1,5a = 1 \Rightarrow a = 0,5(mol)$
Thí nghiệm 2 : $Al$ hết
Gọi $n_{Al} = b(mol)$
Theo PTHH :
$n_{H_2} = \dfrac{1}{2}n_{Na} + \dfrac{3}{2}n_{Al}$
$\Rightarrow \dfrac{1}{2}.0,5 + \dfrac{3}{2}b = 1,75$
$\Rightarrow b = 1(mol)$
Ta có :
$\%m_{Na} = \dfrac{0,5.23}{0,5.23 + 1.27}.100\% = 29,87\%$
Đáp án D

Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al, còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%
=> %Na = 29,87%

Đáp án B
Phần chất rắn chưa tan là Al còn dư
Gọi n K = x mol
Cho hỗn hợp X vào nước, K phản ứng hết tạo KOH và Al phản ứng với KOH và còn dư => tính số mol theo KOH
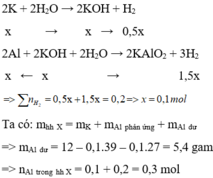
Cho hỗn hợp X tác dụng với dung dịch KOH dư => K phản ứng hết với H 2 O và Al phản ứng hết với KOH
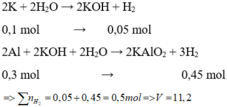

a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Cu+HCl\rightarrow\)(không phản ứng)
2Al + 6HCl => 2AlCl3 + 3H2
0,3/3*2 (6,72/22,4)
=> mAl = 0,2 *27 =5,4g; mCu = 11,8 - 5,4 = 6,4g

Đặt : nNa = x (mol) , nAl = y (mol)
Nhận xét cả 2 thí nghiệm :
TN1 : m (gam) X tác dụng với nước dư được V lít khí
TN2 : cũng với m (gam) X đó tác dụng với dung dịch NaOH dư thì được 1,75V lít khí
chắc chắn ở tn2 Al sẽ hết vì NaOH dư
=> Thể tích khí bay ra ở tn1 nhỏ hơn tn2 là do ở tn1 Al dư
* TN1
Na + H2O → NaOH + \(\frac{1}{2}\)H2
(mol) x.............................x...................0,5x (mol)
Al + NaOH + H2O → NaAlO2 + \(\frac{3}{2}\)H2
(mol) x ..............x.........................................................1,5x
nAl (dư) = y - x (mol) , NaOH hết
Ta có : (0,5x + 1,5x) * 22,4 = V
=> x = \(\frac{5}{224}V\) (mol)
TN2 :
Na + H2O → NaOH + 1/2 H2
(mol) x...............................x.................0,5x
H2O + NaOH + Al → NaAlO2 + 3/2 H2
(mol) y ..............y....................................1,5y
Ta có : ( 0,5x + 1,5y) * 22,4 = 1,75V
=> 11,2 * \(\frac{5}{224}\)V + 33,6y = 1,75V
<=> y = \(\frac{5}{112}V\) (mol)
Vậy : %mNa = \(\frac{\frac{5}{224}\cdot V\cdot23}{\frac{5}{224}\cdot V\cdot23+\frac{5}{112}\cdot V\cdot27}\cdot100\%\) ~ 29,87 (%)
Giả sử :
V = 22.4 l
Vì : V2 > V1 => ở TN1 : Al dư
Đặt :
nNa (bđ) = x mol
nAl(bđ) = y mol
TN1:
Na + H2O --> NaOH + 1/2H2
x____________x______0.5x
NaOH + Al + H2O --> NaAlO2 + 3/2H2
x_______x____________________1.5x
nH2 = 2x = 1
=> x = 0.5
TN2:
nH2(do Al sinh ra ) = 1.75- 0.5/2 = 1.5 mol
NaOH + Al + H2O --> NaAlO2 + 3/2H2
_______1_____________________1.5
mAl= 27 g
mNa = 11.5 g
%Na = 11.5/ ( 27+ 11.5 ) *100% = 29.87%

-Gọi số mol Na là x, số mol Al là y
-X tác dụng với H2O:
2Na+2H2O\(\rightarrow\)2NaOH+H2
x\(\rightarrow\).................x............\(\dfrac{x}{2}\)
2Al+2NaOH+2H2O\(\rightarrow\)2NaAlO2+3H2
x.....\(\leftarrow\)x\(\rightarrow\).....................................\(\dfrac{3x}{2}\)
V=(\(\dfrac{x}{2}+\dfrac{3x}{2}\)).22,4=2x.22,4 lít(I)
-X tác dụng với NaOH:
2Na+2H2O\(\rightarrow\)2NaOH+H2
x\(\rightarrow\).................x............\(\dfrac{x}{2}\)
2Al+2NaOH+2H2O\(\rightarrow\)2NaAlO2+3H2
y\(\rightarrow\)..............................................\(\dfrac{3y}{2}\)
1,75V=\(\left(\dfrac{x}{2}+\dfrac{3y}{2}\right).22,4=\left(\dfrac{x+3y}{2}\right).22,4\)lít(II)
-Lập tỉ số: \(\dfrac{\left(II\right)}{\left(I\right)}\)ta có:
\(1,75=\dfrac{\dfrac{x+3y}{2}}{2x}=\dfrac{x+3y}{4x}\)
\(\rightarrow\)1,75.4x=x+3y\(\rightarrow\)7x=x+3y\(\rightarrow\)6x=3y\(\rightarrow\)2x=y
%Na=\(\dfrac{23x}{23x+27y}.100=\dfrac{23x.100}{23x+27.2x}=\dfrac{2300}{23+27.2}\approx29,87\%\)


Đáp án C
Gọi số mol của Na và Al trong hỗn hợp X lần lượt là x và y mol
Vì tỉ lệ thể tích cũng là tỉ lệ số mol => coi như thí nghiệm 1 thu được a mol khí và thí nghiệm 2 thu được 1,75a mol
Cho hỗn hợp X vào nước, Na phản ứng hết tạo NaOH và Al phản ứng với NaOH và còn dư => tính số mol theo NaOH
Cho hỗn hợp X tác dụng với dung dịch NaOH dư => Na phản ứng hết với H2O và Al phản ứng hết với NaOH