Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
nHNO3 bđ = 1,5 ; nNO2 = 0,2 (mol)
Khi thêm nước lọc vào T và thu được lượng kết tủa max thì phần dung dịch nước lọc chỉ chứa NaNO3.
Bảo toàn N => nNaNO3 = nHNO3 – nNO2 = 1,3 (mol)
=> nNaOH = 1,3 => Vdd NaOH = 1,3 (lít)
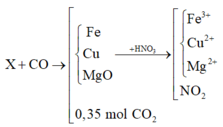
Đặt a, b là số mol Fe3O4 và CuO
mhh = 232a + 80b = 29,2 (1)
Có: nCO2 = nBaCO3 = 0,05 (mol) = nO( trong oxit pư)
Bảo toàn e cả quá trình: nNO2 = nFe3O4 + 2nO (mất đi khi + CO)
=> nFe3O4 = nNO2 - 2nO (mất đi khi + CO) = 0,2 – 2.0,05 = 0,1 (mol)
=> %mFe3O4 = [0,1. 232: 29,2].100% = 79,45%

Sau khi hỗn hợp X bị CO lấy đi 1 phần oxi ⇒ Chất rắn Y.
+ Đặt nFe/Y = a và nO/Y = b ta có:
PT bảo toàn electron: 3a – 2b = 2nSO2 = 0,09 mol (1)
PT theo muối Fe2(SO4)3: 200a = 18 (2)
+ Giải hệ (1) và (2) ta có: a = b = 0,09 mol
⇒ mY = 0,09×(56+16) = 6,48 gam.
+ Mà nO bị lấy đi bởi CO = nCaCO3 = 0,04 mol
⇒ nX = mY + mO bị lấy đi = 6,48 + 0,04×16 = 7,12 gam
Đáp án B

Đáp án C
X + CO tạo thành chất rắn Y gồm các kim loại Mg, Fe, Cu và hỗn hợp khí z gồm CO2 và CO dư
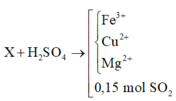
Áp dụng định luật bảo toàn mol electron
Trong thí nghiệm 1: ne nhường = ne nhận = 0,3(mol)
ne nhường trong thí nghiệm = ne nhường (1) + 2.nCO2 =1(mol) = ne nhận (2) = nNO2
Chú ý: Với các bài toán của phản ứng oxi hoá khử gồm nhiều quá trình ta thường sử dụng bảo toàn electron cho toàn bộ các quá trình, bỏ qua giai đoạn trung gian.

Đáp án C
Xét hỗn hợp X có tỷ khối hơi so với H2 bằng 17,67 → n(NO) = n(NO2) = z (mol)
Trong hỗn hợp X gọi số mol FeO = x mol; Fe3O4 = y mol → 72x + 232 y = 33,2 gam (1)
Trong dung dịch Y có: Fe3+: x + 3y (mol); H+; K+ (1,2 mol); SO42- (1,2 mol) và NO3- (06 – 3z mol)
Xét phần I:
PTHH: H+ + OH- → H2O; Fe3+ + 3OH- → Fe(OH)3 (0,1 mol)
→ n(H+ dư) = 0,45 – 0,1*3 = 0,15 mol → n(H+ trong Y) = 0,3 mol
Áp dụng ĐLBT số mol e: (2) x + y = 2z*3 + z
Áp dụng ĐLBT điện tích: 3(x + 3y) + 0,3 + 1,2 = 1,2*2 + 0,6 – 3z
Giải (1) (2) (3) → x = 0,3; y = 0,05; z = 0,05

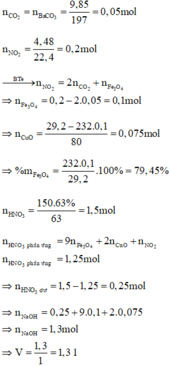




Đáp án A
Có:
Có: