Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHCl = 0,4.0,5 = 0,2 mol; nH2SO4 = 0,08.0,5 = 0,04 mol
nH+ = nHCl + 2nH2SO4 = 0,28 mol
Đặt số mol của Zn và Mg trong hỗn hợp ban đầu là x và y (mol)
Ta có: 65x + 24y = 5,34 (1)
Zn + 2H+ → Zn2+ + H2
x → 2x → x (mol)
Mg + 2H+ → Mg2+ + H2
y → 2y → y (mol)
Dung dịch Y gồm có:
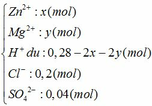
Ta thấy: nH+ + 2nZn2+ + 2nMg2+ (= 0,28 mol) < nNaOH (= 0,3 mol)
=> NaOH dư, Zn(OH)2 bị tan một phần
=> nNaOH hòa tan kết tủa = 0,3 – 0,28 = 0,02 mol
H+ + OH- → H2O
0,28-2x-2y → 0,28-2x-2y (mol)
Zn2+ + 2OH- → Zn(OH)2
x → 2x → x (mol)
Mg2+ + 2OH- → Mg(OH)2
y → 2y → y (mol)
Zn(OH)2 + 2OH- → ZnO22- + H2O
0,01 ← 0,02 (mol)
Khối lượng kết tủa thu được sau phản ứng: m kết tủa = mMg(OH)2 + mZn(OH)2
=> 99(x-0,01) + 58y = 8,43 <=> 99x + 58y = 9,42 (2)
Từ (1) và (2) ta có:

Ta có: nKOH : nBa(OH)2 = 0,4:0,05 = 8
Giả sử số mol của KOH và Ba(OH)2 lần lượt là 8a và a (mol)
=> nBa2+ = a (mol); nOH- = nKOH + 2nBa(OH)2 = 10a (mol)
- Khi kết tủa Mg(OH)2 và Zn(OH)2 đạt giá trị lớn nhất: nOH- = nH+ dư + 2nZn2+ + 2nMg2+
=> 10a = 0,04 + 2.0,06 + 2.0,06 => a = 0,028 mol
Ta thấy a < nSO42- => BaSO4 chưa đạt cực đại
- Giả sử sau khi Mg(OH)2 và Zn(OH)2 đạt cực đại ta thêm 8b mol KOH và b mol Ba(OH)2:
+ Lượng kết tủa sinh thêm là lượng BaSO4: nBaSO4 = nBa(OH)2 = b mol
=> mBaSO4 = 233b (gam)
+ Lượng kết tủa bị tan ra: nZn(OH)2 = nOH-: 2 = 10b : 2 = 5b (mol)
=> mZn(OH)2 = 99.5b = 495b (gam)
Ta thấy khối lượng kết tủa sinh ra nhỏ hơn khối lượng kết tủa bị tan nên khối lượng kết tủa lớn nhất là thời điểm Mg(OH)2 và Zn(OH)2 đạt cực đại. Khi đó: nBa(OH)2 = a = 0,028 mol
=> V = 0,028 : 0,05 = 0,56 (lít)
Kết tủa sau phản ứng gồm có:
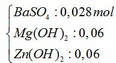
Mg(OH)2 → t ∘ MgO + H2O
0,06 mol → 0,06 mol
Zn(OH)2 → t ∘ ZnO + H2O
0,06 mol → 0,06 mol
=> m = mBaSO4 + mMgO + mZnO = 0,028.233 + 0,06.40 + 0,06.81 = 13,784 gam

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
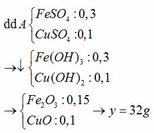

Bắt đầu xuất hiện kết tủa nghĩa là: NaOH đầu tiên sẽ trung hòa HCl dư trước
NaOH + HCldư → NaCl + H2O
0,2 ←0,2
→ 2V1 = 0,2 → V1 = 0,1
Đến khi kết tủa không thay đổi khối lượng thì khi đó kết tủa bị hòa tan hết.
3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
3x ←x → x
NaOH + Al(OH)3 → NaAlO2 + 2H2O
x ←x
→ 0,2 + 4x = 0,6.2 → x = 0,25
=> y = 0,025
=> m = 17,75g

Câu 1
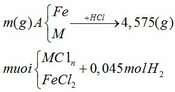
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
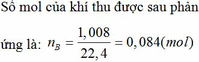
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
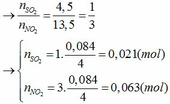
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
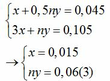
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.


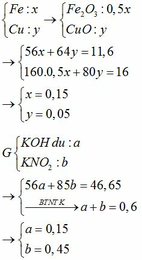
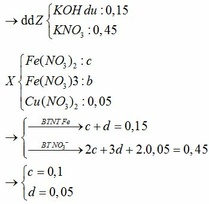

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

Bảo toàn khối lượng :
\(m_{O_2}=3.43-2.15=1.28\left(g\right)\)
\(n_{O_2}=\dfrac{1.28}{32}=0.04\left(mol\right)\)
Bảo toàn O :
\(n_{H_2O}=2n_{O_2}=2\cdot0.04\cdot2=0.08\left(mol\right)\)
Bảo toàn H :
\(n_{HCl}=2n_{H_2O}=2\cdot0.08=0.16\left(mol\right)\)
\(V_{dd_{HCl}}=\dfrac{0.16}{0.5}=0.32\left(l\right)\)
Bảo toàn khối lượng :
\(m_{Muôi}=3.43+0.16\cdot36.5-0.08\cdot18=7.83\left(g\right)\)
Bảo toàn khối lượng:
m oxit = m kim loại + m O
=> mO = 3,43 – 2,15 = 1,28g
=> nO = 0,08 mol
Có nH+ = 2nO = 0,08 . 2 = 0,16 mol
V =\(\dfrac{0,16}{0,5}\)= 0,32 lít = 320ml
\(m_{muối}=m_{KL}+m_{Cl^-}=2,15+0,16.35,5=7,83\left(g\right)\)

\(M_{NO}=M_{C2H6}=30\rightarrow M_{Y'}=1,35.30=40,5,y=0,04mol\)
Gọi x,y là số mol của NO,N2O trong hh ta có hệ:
\(\begin{cases}30x+44y=0,04.40,5\\x+y=0,04\end{cases}\) \(\Rightarrow n_{NO}=x=0,01,n_{N2O}=0,03\)
Gọi a,b là số mol của Fe,R trong 3,3 gam hỗn hợp:
\(Fe+HCl\rightarrow FeCl_2+H_2\)
\(R+nHCl\rightarrow RCl_n+\frac{n}{2H2}\)
\(\Rightarrow56a+Rb=3,3\) (*)
\(\Rightarrow a+\frac{bn}{2}=0,12\) (**)
Hòa tan X trong HNO3
Quá trình oxi hóa
Fe →Fe3+ +3e
R→ Rn+ +ne
Quá trình khử:
NO3- +4H+ +3e → NO +2H2O
0,04 ← 0,03 ←0,01
NO3- +8H+ +8e → N2O +2H2O
0,3 ← 0,24 ←0,03
Áp dụng bảo toàn electron ta có
3a+ nb =0,27 (3)
Từ 2,3 → a=0,03 ,nb=0,18 thay vào 1 ta có: R=9n → n=3,R=27 → là Al
%Fe=(0,03.56/3,3).100%=50,91% → %Al = 49,09%
b, nHNO3pu =nH+ =0,04+0,3=0,34 mol
%Fe=(0,03.56/3,3).100%=50,91% → %Al = 49,09%
b, nHNO3pu =nH+ =0,04+0,3=0,34 mol
nHNO3du =0,01.0,34=0,034 mol=nH+ dư
cho NaOH vào Z
H+ + OH- → H2O
0,034→0,034
Fe3+ + 3OH- → Fe(OH)3
0,03→0,09→0,03
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + OH- →AlO2- + 2H2O
Vì Fe(OH)3 kết tủa hết → nAl(OH)3 =(4,77-3,21)/78=0,02 mol < nAl3+ =0,06 mol → có 2 trường hợp
TH1 : Al3+ dư → nNaOH =0,034 +0,09 +0,06 =0,184 mol → CM(NaOH)=0,184/0,4=0,46M
TH2: Al3+ hết → nNaOH =0,034 +0,09 +0,18 +0,04 =0,344 mol → CM(NaOH)=0,344/0,4=0,86M

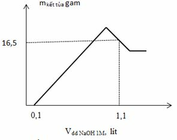




Tóm tắt:
Gọi số mol của N2 và N2O lần lượt là
a và b (mol)
Ta có:
ne (KL nhường) = ne(N+5 nhận)
=> 2x + 3y = 0,5 + 0,4 (1)
Từ đồ thị ta thấy tại giá trị V= 0,1 (lít) tức nNaOH = 0,1 (mol) mới bắt đầu xuất hiện kết tủa=> lượng NaOH này chính là lượng để trung hòa HNO3 dư sau phản ứng=> nHNO3 dư = nNaOH0,1 (mol) Ta thấy tại giá trị V= 1,1 (lít) tức nNaOH = 1,1 (lít) đồ thị đi lên cực đại sau đó lại đi xuống => kết tủa đạt cực đại sau đó bị hòa tan 1 phần ( chỉ có Al(OH)3 bị hoàn tan) Khi cho NaOH từ từ vào dung dich .Z xảy ra phản ứng:
H+ + OH- → H2O
0,1 → 0,1 (mol)
Mg2+ + 2OH- → Mg(OH)2↓
x → 2x (mol)
Al3+ + 3OH- → Al(OH)3↓
y → 3y →y (mol)
Al(OH)3↓ + OH- → AlO2- + 2H2O
(y – z ) → (y –z) (mol)
Gọi số mol của Al(OH)3 còn lại không bị hoàn tan là z (mol)
=> ta có: ∑ nNaOH = nH+dư + 2nMg2+ + 4nAl3+ - nAl(OH)3
=> 0,1 +2x + 4y – z = 1,1 (2)
Mặt khác: ∑ mkết tủa = mMg(OH)2 + mAl(OH)3 chưa hòa tan
=> 58x + 78z = 16,5 (3)
Từ (1), (2) và (3) => x = 0,2 ; y = 0,15 và z = 0,1 (mol)
=> m = mAl + mMg = 0,2.27 + 0,15.24 = 9 (g)
nHNO3 = nHNO3 dư + 2nN2 + 2nN2O + 3nAl(NO3)3 + 2nMg(NO3)2 = 0,1 + 2.0,05 + 2. 0,05 + 3.0,2 + 2.0,15 = 1,2 (mol)
=> VHNO3 = n : CM = 1,2 : 2 = 0,6 (lít) = 600 (ml)