Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

khi cho Fe vào HCl tạo Fe2+
áp dụng định luật bảo toàn e ta có:
Fe => Fe2+ + 2e 2H+ +2e => H2
nFe = 0,05 mol => mFe=2,8 g => mFe2O3 =7,2g => nFe2O3=0,045 mol
nói chung khi nung kết tủa trong không khí đều tạo Fe2O3 => m (chất rắn)= 7,6 g

Mình sẽ làm theo cách tính nhanh :
đầu tiên :
Al +H2SO4 \(\rightarrow Al^{3+}\) ta có số mol :\(n_{Al}=n_{Al^{3+}}=10,8:27=0,4\)
sau đó cho dd tác dụng với dd OH-.có 2 trường hợp xảy ra :
TH1 :OH- thiếu nên \(n_{OH-}=3n_{\downarrow}\)
BTNT Al ta có : \(n_{Al\left(OH\right)_3}=2.n_{Al_2O_3}=2.\left(10,2:102\right)=0,2\)
suy ra 0,5V=3.0,2 suy ra V=1,2
TH2: OH- dư :\(n_{OH-}=4.n_{Al^{3+}}-n_{\downarrow}\) \(\Leftrightarrow0,5V=4.0,4-0,2\)
suy ra V=2,8
từ đó chọn A

Câu 1 :
\(n_{FeCl_3} = \dfrac{28,275}{162,5}=0,174(mol)\\ \)
Fe + 2FeCl3 → 3FeCl2
0,087.......0,174.......0,261...............(mol)
Vậy :
m = 0,087.56 + 11,928 = 16,8(gam)
mmuối = 0,261.127 = 33,147(gam)

Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]() khối lượng rắn giảm
khối lượng rắn giảm
![]() khối lượng rắn tăng
khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt nZn = x; nFe = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 65)y = 8y
m tăng = m giảm =>x = 8y =>%mZn = 65x/(65x - 56y)x100% = 90,27%

Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]()
=> Khối lượng rắn giảm
![]() => Khối lượng rắn tăng
=> Khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt n Z n = x ; n F e = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 56)y = 8y
m tăng = m giảm => x = 8y => %mZn = 65x : (65x - 56y).100% = 90,27%

Đáp án D
Ta có dãy điện hóa như sau:
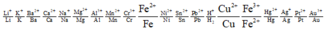
Dễ dàng nhận thấy Fe và Cu đều có khả năng tác dụng với F e 2 + còn Ag thì không.
Nếu đề không nhắc gì đến việc thay đổi khối lượng Ag thì có thể dùng dung dịch A g N O 3

Đáp án D
Ta có dãy điện hóa như sau:
![]()
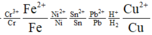
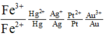
Dễ dàng nhận thấy Fe và Cu đều có khả năng tác dụng với F e 3 + còn Ag thì không.
Nếu đề không nhắc gì đến việc thay đổi khối lượng Ag thì có thể dùng dung dịch A g N O 3



Cu + 2H2SO4 ---> CuSO4 + SO2 + 2H2O
x x
2R + 2nH2SO4 ---> R2(SO4)n + nSO2 + 2nH2O
y y/2
Zn + CuSO4 ---> ZnSO4 + Cu
x x x
nZn + R2(SO4)n ---> nZnSO4 + 2R (4)
ny/2 y/2
TH1. Nếu R là kim loại Al thì không có phản ứng (4) do đó chất rắn thu được là Cu (loại) vì khối lượng Cu sinh ra không thể = khối lượng Zn phản ứng.
TH2. Nếu R là Fe thì phản ứng (4) sẽ là: Zn + Fe2(SO4)3 ---> ZnSO4 + 2FeSO4. Do đó chất rắn thu được sau phản ứng là Cu (x mol = số mol Cu ban đầu) = khối lượng của Zn = 65 (x + y/2). Do đó: 64x = 65(x+y/2) loại. (y là số mol kim loại R ban đầu).
TH3. Nếu R là Ag thì p.ư (4) sẽ là Zn + Ag2SO4 ---> ZnSO4 + 2Ag. Chất rắn thu được sau phản ứng là Cu (x mol) và Ag (y mol). Zn đã phản ứng là x + y/2 mol.
Do đó, ta có: 64x + 108y = 65(x+y/2) hay x = 75,5y. Mặt khác: 64x + 108y = 4,94
Giải hệ thu được y = 0,001 mol. Như vậy %Ag = 0,108.100/4,94 = 2,18% (hợp lí vì đây là tạp chất nên chiếm tỉ lệ % nhỏ).
TH4. Nếu R là Au thì p.ư (4) sẽ là: 2Zn + Au2(SO4)3 ---> 3ZnSO4 + 2Au.
Ta có: 64x + 197y = 65(x+y) hay x = 132y thay vào pt: 64x + 197y = 4,94 thu được y = 0,00057 mol. Do đó %Au = 0,00057.197.100/4,94 = 2,28%.