Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Ta có dãy điện hóa như sau:
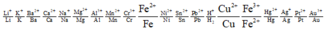
Dễ dàng nhận thấy Fe và Cu đều có khả năng tác dụng với F e 2 + còn Ag thì không.
Nếu đề không nhắc gì đến việc thay đổi khối lượng Ag thì có thể dùng dung dịch A g N O 3

Đáp án D
Ta có dãy điện hóa như sau:
![]()
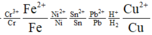
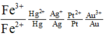
Dễ dàng nhận thấy Fe và Cu đều có khả năng tác dụng với F e 3 + còn Ag thì không.
Nếu đề không nhắc gì đến việc thay đổi khối lượng Ag thì có thể dùng dung dịch A g N O 3

1)
2Al + 6HCl \(->\) 2AlCl3 + 3H2
Fe + 2HCl \(->\) FeCl2 + H2
Gọi a, b là số mol Al, Fe.
Ta có :
27a + 56b = 25,4 - 3,2 = 22,2
1,5a + b = 13,44/22,4 = 0,6
=> a = 0,2 mol
b =0,3 mol
=> \(\left\{{}\begin{matrix}mCu=3,2\left(g\right)\\mAl=0,2.27=5,4\left(g\right)\\mFe=0,3.56=16,8\left(g\right)\end{matrix}\right.\)
2)
- Cho hỗn hợp vào dung dịch HCl dư, lọc chất rắn rửa sạch, sấy khô thu Cu nguyên chất
PTHH :
CuO + 2HCl \(->\) CuCl2 + H2O
Fe + 2HCl \(->\) FeCl2 + H2
Fe2O3 + 6HCl \(->\) 2FeCl3 + 3H2O

Câu 1 : Kim loại trong dãy có nhiệt độ nóng chảy cao nhất là
A. W. B. Fe. C. Al. D. Na.
Câu 2: . Có các loại kim loại: Zn, Ni, Sn, Cu. Kim loại có thể dùng để bảo vệ điện hoá vỏ tàu biển làm bằng thép là
A. Sn. B. Ni. C. Zn. D. Cu.
Câu 3: Kim loại có thể điều chế bằng phương pháp điện phân dung dịch muối halogenua là
A. Na. B. Cu. C. Ca. D. K.
Câu 4: Ngâm một đinh sắt sạch trong dung dịch HCl thì sắt bị ăn mòn chậm. Nếu thêm vài giọt CuSO4 thì sắt ăn mòn nhanh hơn. Thí nghiệm trên chứng tỏ
A. Fe bị ăn mòn hoá học, sau đó bị ăn mòn điện hoá học.
B. Đây là hiện tượng ăn mòn điện hoá học.
C. Đây là hiện tượng ăn mòn hoá học.
D. Fe bị ăn mòn điện hoá, sau đó bị ăn mòn hoá học.
Câu 5: Thuỷ ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thuỷ ngân bị vỡ thì dùng chất nào trong các chất sau đây để khử độc thuỷ ngân?
A. Bột lưu huỳnh. B. Bột Fe. C. Bột than. D. Nước.
Câu 6: Cho 9,75 gam một kim loại M tác dụng hết với nước thu được 2,8 lít khí (đktc). Kim loại M là
A. Li. B. Ca. C. Na. D. K.
Câu 7. Điện phân(điện cực trơ) dung dịch muối đồng (II) clorua với dòng điện cường độ 3A. Sau 1930 giây thì dừng quá trình điện phân. Khối lượng kim loại thoát ra ở catot là
A. 1,92 g. B. 1,29 g. C. 19,2g. D. 12,9g.
Câu 8. Chất nào sau đây được dùng bó bột khi xương bị gãy?
A. Vôi tôi. B. Đá vôi. C. Tinh bột. D. Thạch cao.
Câu 9: Hiện tượng nào xảy ra khi cho kim loại K vào dung dịch CuSO4?
A. Có kết tủa màu đỏ, dung dịch nhạt dần.
B. Sủi bọt khí không màu và có kết tủa màu đỏ.
C. Có kết tủa màu đỏ.
D. Sủi bọt khí không màu và có kết tủa màu xanh.
Câu 10: Kim loại không tác dụng với nước ở nhiệt độ thường là
A. Na. B. Ca. C. Sr. D. Mg.
Câu 11: Nhỏ từ từ dung dịch NaOH vào dung dịch X thấy dung dịch vẩn đục. Nhỏ tiếp dung dịch NaOH vào thấy dung dịch trong trở lại. X là dung dịch nào sau đây?
A. Al2(SO4)3. B. Fe2(SO4)3. C. NaAlO2. D. (NH4)2SO4.
Câu 12: Chỉ dùng một hoá chất để phân biệt 3 chất rắn Mg, Al2O3, Al . Hoá chất đó là
A. H2SO4. B. NaOH. C. Al(OH)3 D. HCl.
Câu 13: Cho m gam kim loại Al tác dụng với một lượng dư dung dịch NaOH, thu được 3,36 lít khí H2 (ở đktc). Giá trị của m là: ( Cho Al = 27, H = 1)
A. 8,1g. B. 2,7g. C. 5,4g. D. 10,8g.
Câu 14: Sục a mol khí CO2 vào dung dich Ca(OH)2 dư thu được 3 gam kết tủa. Giá trị của a là
A. 0,03 mol. B. 0,04 mol. C. 0,05 mol. D. 0,06 mol.
Câu 15: Chất nào sau đây là chất khử oxit sắt trong lò cao?
A. H2. B. CO. C. Al. D. Na.
Câu 16: Kim loại không phản ứng được với H2SO4 đặc nguội là
A. Cu. B. Ag. C. Fe. D. Mg.
Câu 17: Cho kim loại Fe vào dung dịch Fe3+ có màu vàng. Hiện tượng gì sẽ xảy ra.
A. Dung dịch chuyển từ màu vàng sang màu lục nhạt.
B. Dung dịch chuyển từ màu vàng sang màu đỏ nâu.
C. Dung dịch chuyển từ màu vàng sang màu xanh lam.
D. Dung dịch giữ nguyên màu vàng.
Câu 18: Để phân biệt 2 mẫu hợp kim: Al-Fe và Fe-Cu. Người ta có thể dùng hóa chất nào sau đây:
A. Nước. B. dung dịch muối ăn. C. dung dịch HCl. D. Quỳ tím.

1. Gọi x,y lần lượt là số mol của CuO, Fe2O3
Pt: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\) (1)
x \(\rightarrow x\)
Pt; \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\) (2)
y \(\rightarrow y\)
Theo gt: \(\dfrac{n_{CuSO_4}}{n_{Fe_2\left(SO_4\right)_3}}=\dfrac{2}{3}\)
(1)(2) \(\dfrac{n_{CuSO_4}}{n_{Fe_2\left(SO_4\right)_3}}=\dfrac{x}{y}\)
--------------------------- ( múc hai cái lại )
\(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
\(\Rightarrow x=\dfrac{2y}{3}\)
\(m_{CuO}=\dfrac{2y}{3}.80=\dfrac{160}{3}y\)
\(m_{Fe_2O_3}=160y\)
\(m_{hh}=\dfrac{160}{3}y+160y=\dfrac{640y}{3}\)
\(\%_{CuO}=\dfrac{\dfrac{160}{3}y}{\dfrac{640}{3}y}.100=25\%\)
\(\%_{Fe_2O_3}=\dfrac{160y}{\dfrac{640}{3}y}.100=75\%\)
3. \(n_{H_2SO_4}=0,2.1,5=0,3\left(mol\right)\)
Gọi x,y lần lượt là số mol của Al2O3 ; CaO
Pt: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\) (1)
x \(\rightarrow\) 3x
\(CaO+H_2SO_4\rightarrow CaSO_4+H_2O\) (2)
y \(\rightarrow\) y
(1)(2) \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,3\\102x+56y=11,52\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}x=0,08\\y=0,06\end{matrix}\right.\)
a) \(m_{Al_2O_3}=0,08.102=8,16\left(g\right)\)
\(m_{CaO}=0,06.56=3,36\left(g\right)\)
b) Pt: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\) (3)
0,08mol \(\rightarrow\) 0,48mol
\(CaO+2HCl\rightarrow CaCl_2+H_2O\) (4)
0,06mol\(\rightarrow\) 0,12mol
(3)(4) \(\Rightarrow\Sigma_{n_{HCl}}=0,48+0,12=0,6\left(mol\right)\)
\(m_{dd_{HCl}}=\dfrac{0,6.36,5}{15}.100=146\left(g\right)\)


Đáp án B
2Al + 3Cu2+ → 2Al3+ + 3Cu; Fe + Cu2+ → Fe2+ + Cu
Lọc dung dịch thu được Cu tinh khiết.