Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

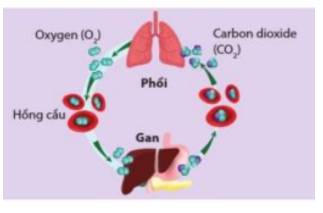
Do đường glucose đã phản ứng với oxygen tạo ra carbon dioxide, hơi nước, tỏa nhiều nhiệt và giải phóng được 36 ATP nên đường glucose bù năng lượng cho cơ thể.

Câu 4 :
$n_{H_2SO_4} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
Bảo toàn khối lượng :
$m = 4,025 + 0,15.98 - 0,15.2 = 18,425(gam)$
Câu 5 :
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
$n_{SO_2} = \dfrac{3}{2}n_{Fe} = 0,225(mol)$
$V_{SO_2} = 0,225.22,4 = 5,04(lít)$
Câu 3: Theo gt ta có: $n_{SO_2}=0,125(mol);n_{NaOH}=0,2(mol)$
Gọi số mol $Na_2SO_3$ và $NaHSO_3$ lần lượt là a;b
Ta có: $a+b=0,125;2a+b=0,2$
Giải hệ ta được $a=0,075;b=0,05$
$\Rightarrow m_{muoi}=14,65(g)$
Câu 4: Theo gt ta có: $n_{H_2}=0,15(mol)$
Bảo toàn H ta có; $n_{H_2SO_4}=0,15(mol)$
$\Rightarrow m_{muoi}=m_{KL+m_{SO_4^{2-}}=18,425(g)$
Câu 5: Theo gt ta có: $n_{H_2}=n_{Fe}=0,15(mol)$
Bảo toàn e ta có: $n_{SO_2}=0,225(mol)\Rightarrow V_{SO_2}=5,04(l)$

- Sự hô hấp cung cấp oxygen cho các phản ứng oxi hóa chất béo, chất đường, tinh bột,... trong cơ thể con người đó là các phản ứng giải phóng năng lượng
- Năng lượng kèm theo các phản ứng dùng để cung cấp năng lượng cho các hoạt động

1. So sánh tính kim loại của sodium và magnesium
1. Phương trình hóa học2Na + 2H2O -> 2NaOH + H2
2. Ở điều kiện thường:
- Sodium phản ứng mãnh liệt với nước, tạo dung dịch màu hồng và tỏa nhiệt.
- Magnesium không phản ứng với nước.
2. So sánh tính phi kim của chlorine và iodine
- Hiện tượng: Dung dịch không màu chuyển thành màu nâu của Iodine
=> Cl đẩy được I ra khỏi dung dịch KI => Tính phi kim của iodine yếu hơn chlorine

1.
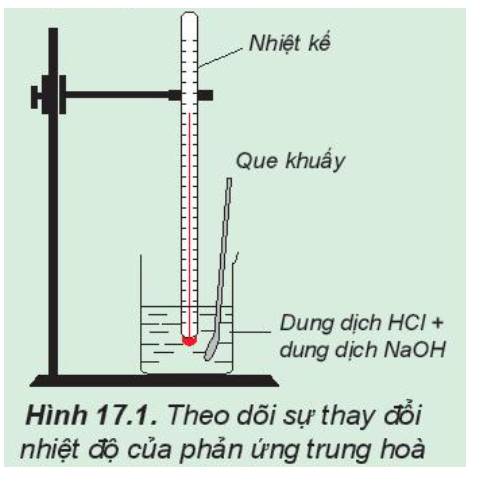
Phản ứng hóa học: NaOH + HCl → NaCl + H2O
Nhiệt độ đo được (HCl) lúc ban đầu thấp hơn so với nhiệt độ sau phản ứng
=> Phản ứng trung hòa là phản ứng tỏa nhiệt
2.
Trong thí nghiệm trên, nếu thay các dung dịch HCl và NaOH bằng các dung dịch loãng hơn thì nhiệt độ sau phản ứng vẫn tăng nhưng tăng ít hơn so với thí nghiệm trên.