Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{FeO}=a\left(mol\right),n_{ZnO}=b\left(mol\right)\)
\(m_{hh}=72a+81b=15.3\left(g\right)\left(1\right)\)
\(TC:n_{FeO\left(pư\right)}=0.8a\left(mol\right),n_{ZnO\left(pư\right)}=0.8b\left(mol\right)\)
\(FeO+CO\underrightarrow{t^0}Fe+CO_2\)
\(ZnO+CO\underrightarrow{t^0}Zn+CO_2\)
\(BTKL:\)
\(15.3+28n_{CO}=12.74+44n_{CO}\)
\(\Rightarrow n_{CO}=\dfrac{15.3-12.74}{44-28}=0.16\left(mol\right)\)
\(\Rightarrow0.8a+0.8b=0.16\left(2\right)\)
\(\left(1\right),\left(2\right):a=b=0.1\)
\(\%FeO=\dfrac{0.1\cdot72}{15.3}\cdot100\%=47.06\%\)
\(\%ZnO=52.94\%\)

bạn tự gọi ẩn nha :))))
PTFƯ: CO + FeO ==> Fe + CO2
.................a.........a..............a........a
CO + ZnO ===> Zn + CO2
................b..........b...............b...........b
nhìn vào phương trình phản ứng, ta có:
mhỗn hợp = mFeO + mZnO = 72a+ 81b = 15.5 (g)
mchất rắn thu đc nếu phản ứng hết = mthực tế : H= 9.68 : 80%=12.1
==> mFe + mZn = 56a + 65b = 12.1
Ta có hệ: 72a + 81b=15.5 và 56a + 65b = 12.1
== > a=0.19, b=0.022
==> %mFeO trong hh lúc đầu = \(\dfrac{0.19x72}{15.5}\) . 100% = 88.258%
===> %mZnO
bạn nhớ tick đúng cho mik nha ^_~
ọi x,y lần lượt là số mol của FeO và ZnO trong hỗn hợp.
=> 72x + 81y = 15,3 gam (1)
FeO + CO --> Fe + CO2
ZnO + CO --> Zn + CO2
** Cách 1:
H = 80% => Hỗn hợp chất rắn sau phản ứng gồm: 0,8x mol Fe, 0,8y mol Zn, 0,2x mol FeO và 0,2y mol ZnO
Ta có PT: 0,8x.56 + 0,8y.65 + 0,2x.72 + 0,2x.81 = 12,74 <=> 59,2x + 68,2y = 12,74 (2)
(1) và (2) => x = y = 0,1 mol => %FeO = 47,06%; %ZnO = 52,94%
*** Cách 2:
Số mol FeO và ZnO đã phản ứng là 0,8x mol và 0,8y mol.
Áp dụng định luật bảo toàn khối lượng:
15,3 + mCO = 12,74 + mCO2 => 2,56 = 0,8(x+y).44 - 0,8(x+y).28 => 12,8(x+y) = 2,56
<=> x + y = 0,2 (3)
Từ (1) và (3) => x = y = 0,1 mol

c) PTHH : FeO + CO -to--> Fe + CO2
mCR(giảm) = mO(FeO) = 15,3 - 12,74 = 2,56 (g)
=> nO(FeO) = 0,16 (mol) = nFeO
=> mFeO = 0,16.72 = 11,52 (g)
=> mZnO = 15,3 - 11,52 = 3,78 (g)
%mFeO = 11,52.100%/15,3 = 75,3%
%mZnO = 100% - 75,3% = 24,7%
d) Fe + 2HCl ----> FeCl2 + H2
ZnO + 2HCl ---> ZnCl2 + H2O
nZnO = 3,78/81=7/150 (mol)
Theo pthh : tổng nHCl = 2nFe + 2nZnO = 0,16.2 + 2.7/150 =31/75 (mol)
=> mHCl = 36,5.31/75 = 15,086 (g)

Gọi \(\left\{{}\begin{matrix}n_{Fe2O3}:x\left(mol\right)\\n_{CuO}:y\left(mol\right)\end{matrix}\right.\)
\(Fe_2O_3+3CO\rightarrow2Fe+3CO_2\)
\(CuO+CO\rightarrow Cu+CO_2\)
\(160x+80y=24\)
\(n_{O\left(bi.khu\right)}=3n_{Fe2O3\left(pư\right)}+n_{CuO\left(pư\right)}=3x.80\%+y.80\%=\frac{24-18,88}{16}=0,32\left(mol\right)\)
\(\Rightarrow x=y=0,1\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe2O3}=\frac{160x}{24}=66,67\%\\\%m_{CuO}=100\%-66,67\%=33,33\%\end{matrix}\right.\)

Phương trình hóa học:
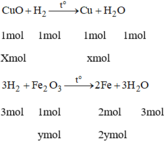
Gọi x là số mol của CuO
y là số mol của F e 2 O 3 .
Ta có: 80x + 160y = 16 (1)
Khối lượng hỗn hợp giảm do oxit tạo thành kim loại:
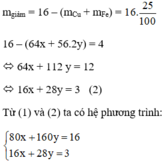
Giải hệ phương trình ta được:
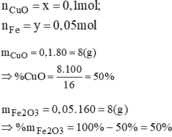

\(d_{hhA}\)/\(CH_4=\overline{\dfrac{M_{hhA}}{16}}\)=4,6
=>\(\overline{M_{hhA}}\)=4,6\(\cdot16\)=73,6
Gọi \(n_1,n_2\)lần lượt là số mol của \(SO_2\),\(SO_3\)
Ta có \(\dfrac{64n_1+80n_2}{n_1+n_2}\)
<=> \(73,6\left(n_1+n_2\right)=64n_1+80n_2\)
<=>\(73,6n_1+73,6n_2=64n_1+80n_2\)
<=>\(9,6n_1=6,4n_2=>n_2=\dfrac{9,6n_1}{6,4}=1,5n_1\)
Vậy \(\%n_{SO_2}=\dfrac{n_1}{n_1+n_2}\cdot100\%\)
mà \(n_2=1,5n_1\)nên ta có
\(\%n_2=\dfrac{1,5n_1}{1,5n_1+n_1}\cdot100\%\)
<=>\(\%n_2=\dfrac{1,5n_1}{2,5n_1}\cdot100\%\)
<=>\(\%n_2=60\%\)
=>\(\%n_1=100-60=40\%\)
Vì \(V=n\cdot22,4\) nên %n cũng chính là % về v
<=>\(\%V_1=60\%\) ; %\(V_2=40\%\)



Đặt :
nFeO (bđ) = a (mol)
nZnO ( bđ) = b (mol)
=> mhh = 72a + 81b = 15.3 (g) (1)
FeO + H2 -to-> Fe + H2O
ZnO + H2 -to-> Zn + H2O
m chất rắn = mFeO dư + mZnO dư + mFe + mZn
=> 0.2a*72 + 0.2b*81 + 56*0.8a + 65*0.8b = 12.74
=> 59.2a + 68.2b = 12.74 (2)
(1) , (2) :
a = b = 0.1
%FeO = 0.1*72/15.3 * 100% = 47.06%
%ZnO = 100 - 47.06 = 52.94%