Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
Catot : Cu2+ + 2e -> Cu2+
Anot : 2H2O -> 4H+ + O2 + 4e
Do dung dịch vẫn còn màu xanh nên Cu2+ dư
=> nH+ = 2nCu = 0,25 mol
Khi cho Fe vào thì :
Fe + 2H+ -> Fe2+ + H2
0,125 <- 0,25 mol
Fe + Cu2+ -> Fe2+ + Cu
.x <- x
=> mFe bđ – mKL sau = 56.(0,125 + x) – 64x = 16,8 – 12,4
=> x = 0,325 mol
=> nCu2+ bđ = 0,125 + 0,325 = 0,45 mol
=> CM (CuSO4) = 2,25M

Do dd Y vẫn còn màu xanh => Cu2+ chưa điện phân hết. Gọi a là số mol đã Cu2+ điện phân.
Cu2+ + 2e ---> Cu
a............2a.........a
2H2O ---> 4H+ + O2 + 4e
.................2a.....0.5a....2a
Ta có: mgiảm = mCu + mO2
=> 64a + 0.5a*32 = 8 => a = 0.1
nCu2+ chưa đp = 0.2x - 0.1
Fe + 2H+ --->....
0.1....0.2
Fe + Cu2+ ----> Cu
0.2x-0.1.............0.2x-0.1
mFe bđầu - mFe pứ acid + mtăng do Fe + Cu2+ = mkl
=> 16.8 - 0.1*56 + 8*(0.2x - 0.1) = 12.4
=> x = 1.25
=> Đáp án D

Đáp án : A
Khi cho Fe vào thấy khối lượng kim loại thu được tăng => Còn Cu2+
+) Catot : Cu2+ + 2e -> Cu
,a -> 2a -> a
+) Anot : 2H2O – 4e -> 4H+ + O2
,2a -> 2a -> 0,5a
=> mgiảm = 4 = mCu pứ + mO2 = 64a + 16a => a = 0,05 mol
Dung Dịch sau điện phân có b mol Cu2+ và 0,1 mol H+
=> mKL sau – mKl trước = mCu – mFe pứ = 64b – 56.( b + 0,1.0,5) = 38,2 – 36,4
=> b = 0,575 mol
=> x = 1,25M

Đáp án B
nFe = 0,01; nMg = 0,005
Δm = 0,92 – 0,56 – 0,12 = 0,24
Mg + Cu2+ → Mg2+ + Cu
0,005 → 0,005 → 0,005
=> Δm1 = 0,005(64 – 24) = 0,2 => Δm2 = 0,24 – 0,2 = 0,04
Fe + Cu2+ → Fe2+ + Cu
x x x
=> (64 – 56)x = 0,04 => x = 0,005
Vậy nCuSO4 = 0,005 + 0,005 = 0,01 => CM = 0,01/0,25 = 0,04M

Đáp án A
P1: + NaOH → H2 → có Al dư → n A l = 2 3 n H 2 = 0 , 09 m o l
P2: Bảo toàn e: 2 n C u + n A g + 3 n A l = 3 n N O → 2 n C u + n A g = 0 , 021 m o l
Lại có: 64 n C u + 108 n A g + 27 n A l = 3 , 33 g → 64 n C u + 108 n A g = 0 , 9 g
→ n C u = 0 , 009 ; y = 0 , 003 m o l
Trong 6,66g B có: 0,018 mol Cu ; 0,006 mol Ag ; 0,18 mol Al
Dung dịch C + HCl không tạo kết tủa → không có Ag+
+) Dung dịch D + thanh Fe:
m g i ả m = m F e p ư - m C u r a = 56 ( n F e ( a x ) + n F e ( C u 2 + ) ) - 64 n C u 2 +
Lại có: n F e ( a x ) = n H 2 = 0 , 04 m o l → n C u 2 + = 0 , 012 m o l
Bảo toàn nguyên tố:
n A g 2 S O 4 = 1 / 2 n A g ( B ) = 0 , 003 m o l ; n C u S O 4 = n C u ( B ) + n C u ( C ) 2 + = 0 , 015 m o l
→ m A g 2 S O 4 ( X ) = 16 , 32 %


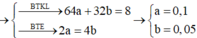
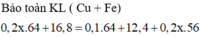



Chọn C