Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. Giả sử hỗn hợp A có X mol C n H 2 n + 2 và y mol C m H 2 m + 2 :
(14n + 2)x + (14m + 2)y = 1,36 ⇒ 14(nx + my) + 2(x + y) = 1,36 (1)
Khi đốt hỗn hợp A:
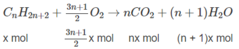
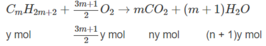
n C O 2 = n C a C O 3 = 0,09(mol)
⇒ nx + my = 0,09 (2)
Từ (1) và (2), tìm được x + y = 0,05.
Số mol O 2 trước phản ứng: n O 2 = 0,2(mol).
Tổng số mol khi trước phản ứng: 0,2 + 0,05 = 0,25 (mol).
Nếu ở đktc thì V O = 0,25.22,4 = 5,6 (lít).
Thực tế V 1 = 11,2 (lít)
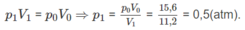
Số mol hơi nước: (n + 1)x + (m + 1)y = nx + my + x + y = 0,14
Số mol O 2 dự phản ứng:
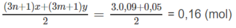
Số mol O 2 còn dư: 0,2 - 0,16 = 0,04 (mol).
Tổng số mol khí sau phản ứng: 0,09 + 0,14 + 0,04 = 0,27 (mol).
Nếu ở đktc thì V ' O = 0,27.22,4 = 6,048 (lít)
Thực tế V 2 = 11,20 (lít)
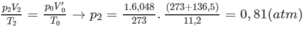
2) Nếu n < m thì x = 1,5y;
Vậy x = 0,03; y = 0,02
0,03n + 0,02m = 0,09 ⇒ 3n + 2m = 9
3n = 9 - 2m 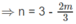
n và m nguyên dương nên m = 3 và n = 1.
C H 4 chiếm 60% thể tích hỗn hợp.
C 3 H 8 chiếm 40% thể tích hỗn hợp.

Áp dụng CT: P1V1/n1.T1 = P2.V2/n2.T2
Ta có: 2.V/n1.T = 1,4.V/n2.T
Hay n2 = 0,7n1.
Giả sử số mol hh khí ban đầu là 10 mol, nếu phản ứng vừa đủ, sau khi ngưng tụ hơi nước thì số mol khí CO2 trong bình là n mol.
Do đó: n = 0,7.10 = 7.
Vậy A là C7H16. (heptan).

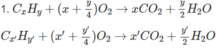
H 2 S O 4 + n H 2 O → H 2 S O 4 .n H 2 O
2NaOH + C O 2 → N a 2 C O 3 + H 2 O
Số mol
C
O
2
là: 
Khối lượng C trong hỗn hợp A là: 0,095.12 = 1,14 (g).
Khối lượng H trong hỗn hợp A là: 1,3 - 1,14 = 0,16 (g).
Số mol
H
2
O
sau phản ứng là: 
Để tạo ra 0,095 mol C O 2 cần 0,095 mol O 2 ;
Để tạo ra 0,08 mol H 2 O cần 0,04 (mol) O 2 .
Số mol O 2 đã tham gia phản ứng là: 0,095 + 0,04 = 0,135 (mol).
Số mol
O
2
ban đầu là: 
Số mol O 2 còn dư là: 0,155 - 0,135 = 0,02 (mol).
Số mol 3 chất trong bình sau phản ứng:
0,095 + 0,08 + 0,02 = 0,195 (mol).
Nếu ở đktc thì V O = 0,195.22,4 = 4,37 (lít).
Thực tế V2 = 8,4 lít
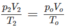
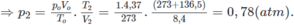
2. Đổi thể tích hỗn hợp khí trước phản ứng về đktc:
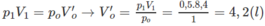
Số mol khí trước phản ứng: 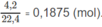
Số mol 2 hiđrocacbon: 0,1875 - 0,155 = 0,0325 (mol).
Đặt lượng C n H 2 n là a mol, lượng C m H 2 m - 2 là b mol, ta có a + b = 0,0325.
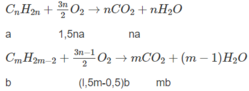
Số mol O 2 : l,5na + (l,5m - 0,5)b = 0,135 (2)
Số mol C O 2 : na + mb = 0,095 (3)
Từ (2) và (3), tìm được b = 0,015 ⇒ a = 0,0175
Thay các giá trị của a và b vào (3), ta có :
1,75. 10 - 2 n + 1,5. 10 - 2 m = 9,5. 10 - 2
7n + 6m = 38
Nếu n = 2 thì 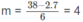
Nếu n = 3 thì 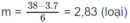
Nếu n > 3 thì m < 2 (loại).
% về thể tích của
C
2
H
4
: 
% về thể tích của C 4 H 6 là 46,2%

Đáp án D
phản ứng cháy
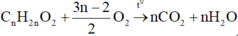
Với bài này, thông thường các bạn thường nghĩ tới tính được tổng số mol khí trước và sau phản ứng, tuy nhiên với dữ kiện giả thiết không đủ cho ta tính các số liệu trên trên.
Mà với tổng số mol khí trước phản ứng bất kì, trong điều kiện bình kín không thay đổi và nhiệt độ trước và sau phản ứng như nhau thì ta luôn có:
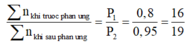
Do đó để cho đơn giản, ta chọn 1 mol CnH2nO2 ban đầu, khi đó:
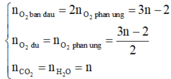
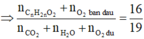
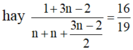
⇔ n=3
Vậy X là C3H6O2.

Đáp án B
Để đơn giản cho việc tính toán ta chọn số mol của A là 1 mol và của O2 là 4 mol (Vì ankan chiếm 20% và O2 chiếm 80% về thể tích).
Phương trình phản ứng :
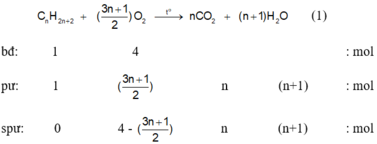
Vì sau phản ứng hơi nước đã ngưng tụ nên chỉ có O2 dư và CO2 gây áp suất nên bình chứa.
Tổng số mol khí trước phản ứng : n1 = 1 + 4 = 5 mol
Tổng số mol khí sau phản ứng :
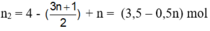
Do nhiệt độ trước và sau phản ứng không đổi nên :

Vậy A là C2H6


Giả sử số mol hỗn hợp ban đầu là 1 mol
--> nA=0,9(mol) , nO2=0,1(mol)
pt CnH2n+2 + (3n+1)/2 O2 ---> nCO2 + (n+1)H2O (*)
Từ (*) => nA phản ứng là 0,2/(3n+1) mol, nCO2 = 0,2n/(3n+1) mol
Số mol hh sau phản ứng là 0,9 - 0,2/(3n+1) + 0,2n/(3n+1) mol
Áp dụng pt trạng thái Vp=nRT ta có
n hh ban dau/ n hh sau phản ứng = p1/p2 = 2/1,4
tức là 1/(0,9 - 0,2/(3n+1) + 0,2n/(3n+1)) = 2/1,4
biến đổi đại số tìm được n.
Nếu ko tìm được n thì đề bài có vấn đề.
Mình tìm ra n = 0, nếu sửa đề bài là áp suất bình sau phản ứng là 1,8 atm thì kết quả là CH4