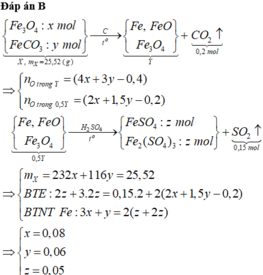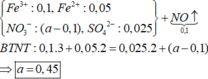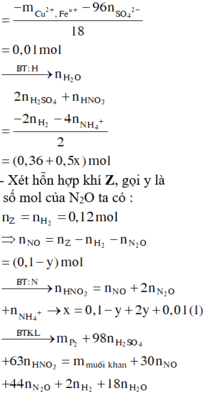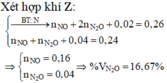Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D
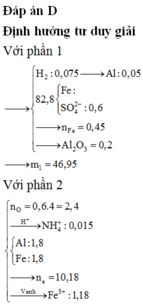
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
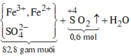
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18

Phản ứng nhiệt nhôm:
![]()
X tác dụng với NaOH thu được => Al dư (*)
Phản ứng xảy ra hoàn toàn (**)
Kết hợp (*), (**) => F e 3 O 4 hết => X gồm Fe, A l 2 O 3 và Al dư
Chú ý: Bài toán chia làm hai phần không bằng nhau
*Xét phần một
Số mol H2 thu được là: ![]()
Trong X, chỉ có Al2O3 và Al dư tác dụng với NaOH theo sơ đồ sau:
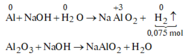
![]()
![]()
Chất rắn thu được là Fe
Chất rắn thu được tác dụng với H2SO4 đặc, nóng:
Sơ đồ phản ứng:
![]()
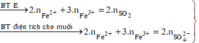
![]()
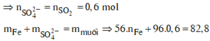
![]()
![]()
![]()
![]()
![]()
![]()
![]()
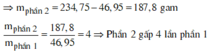
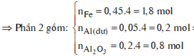
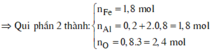
*Xét phần hai:
Số mol HNO3 là: ![]()
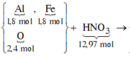
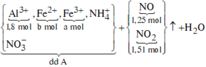
Các quá trình tham gia của H+:
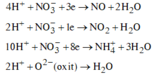
![]()
![]()
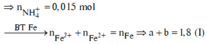
![]()
![]()
![]()


Theo giả thiết: mO = 0.25a (g) => mKL = 0.75a (g);
=> nO = 0.25a/16 mol. nZ = nCO = 1.344/22.4 = 0.06 mol.
M (Z gồm CO & CO2)
Mz = 18*2 = 36 => nCO = nCO2 = 0.03 mol
=> nO pư( nguyên tử) = 0.03 mol => nO còn lại = 0.25a/16 -0.03 mol
Từ khối lượng muối = 3.08a => mNO3(-) = 3.08a - 0.75a = 2.33a (g).
Từ nNO = 0.04 => nNO3( trong muối) = 0.04*3 = 0.12 mol( ĐCGĐ)
Lượng NO3 tạo từ oxi: nNO3/oxit = 2.33a/62 - 0.12 mol
Từ đó suy ra: nNO3/oxit = 2* nO(còn lại) <=>2* (2.33a /62 - 0.12) = 0.25a/16 - 0.03 => a = 9.4777
=> Đáp án C

Chọn B.
Đốt cháy E thu được H2O (0,7 mol) và Na2CO3 (0,3 mol)
Muối thu được là RCOONa (0,2 mol) và R’(COONa)2 (0,2 mol)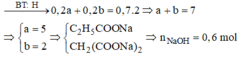
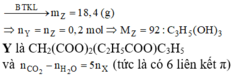
Vậy X là CH2(COO)2(CH≡C-COO)C3H5 Þ 8 nguyên tử H