Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi hóa trị của M là n
Gọi nMg = x mol ⇒ nFe = 3.x mol
Số mol H2 là: nH2 = 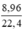 = 0,4 (mol)
= 0,4 (mol)
Số mol Cl2 là: nCl2 = 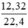 = 0,55 (mol)
= 0,55 (mol)
Các PTHH
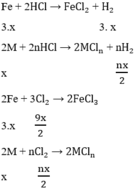
Theo bài ra ta có hệ phương trình:
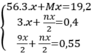
Giải hệ pt ⇒ x = 0,1 mol ⇒ n = 2 ⇒ M = 24
Vậy M là Mg
nMg = 0,1 mol ⇒ nFe = 0,3 mol
Thành phần % theo khối lượng
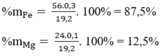

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
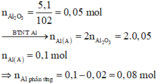
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
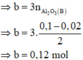
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
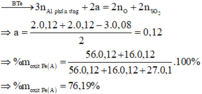

a) Gọi số mol Mg, Al là a, b (mol)
=> 24a + 27b = 1,98 (1)
PTHH: Mg + 2HCl --> MgCl2 + H2
a--->2a-------->a---->a
2Al + 6HCl --> 2AlCl3 + 3H2
b---->3b------->b----->1,5b
=> \(n_{H_2}=a+1,5b=\dfrac{2,352}{22,4}=0,105\left(mol\right)\) (2)
(1)(2) => a = 0,015 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,015.24}{1,98}.100\%=18,18\%\\\%m_{Al}=\dfrac{0,06.27}{1,98}.100\%=81,82\%\end{matrix}\right.\)
b)
\(\left\{{}\begin{matrix}m_{MgCl_2}=0,015.95=1,425\left(g\right)\\m_{AlCl_3}=0,06.133,5=8,01\left(g\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}C_{M\left(MgCl_2\right)}=\dfrac{0,015}{0,16}=0,09375M\\C_{M\left(AlCl_3\right)}=\dfrac{0,06}{0,16}=0,375M\\C_{M\left(HCl.dư\right)}=\dfrac{0,16.1,5-0,015.20,06.2}{0,16}=0,5625M\end{matrix}\right.\)

\(n_{HCl}=0,3.1=0,3mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,1 0,3 0,15 ( mol )
\(m_{Al}=0,1.27=2,7g\)
\(\Rightarrow m_{Al}=9,1.2,7=6,4g\)
\(V_{H_2}=0,15.22,4=3,36l\)
nHCl = 0,3 . 1 = 0,3 (mol)
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2
Mol: 0,1 <--- 0,3 ---> 0,1 ---> 0,15
mAl = 0,1 . 27 = 2,7 (g(
mCu = 9,1 - 2,7 = 6,4 (g)
VH2 = 0,15 . 22,4 = 3,36 (l)

\(n_{H_2}=\dfrac{12,32}{22,4}=0,55mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Gọi x, y lần lượt là số mol của Fe và Al:
\(\left\{{}\begin{matrix}56x+27y=13,7\\x+2y=0,55\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,2\end{matrix}\right.mol\)
\(\%m_{Fe}=\dfrac{0,15.56}{13,7}.100\%=61,31\%\)

Giải thích:
Ở phần 1 khi cho tác dụng với NaOH có sinh ra khí H2 => nhôm dư
Phần 1
nH2 = 0,0525 mol => nAl dư = 0,035 mol
chất rắn không tan tác dụng với HCl => nH2 = 0,045 mol => nFe = 0,045 mol
Phần 2
nH2 = 0,2925 mol
Giả sử phần 2 = k. phần 1
Bảo toàn e ở phần 2 ta có (3 . 0,035 + 2 . 0,045) . k = 2 . 0,2925 => k = 3
Có mA = mB = 4 khối lượng phần 1
=> tổng lượng H2 ở thí nghiệm 1 = 4 . (0,0525 + 0,045 ) = 0,39
=> nFe3O4 = (4 . 0,045) : 3 = 0,06 mol
=> 3nAl = 2.nFe3O4 + 2nH2 => nAl = 0,3 mol
=> mA = 0,3 . 27 + 0,06 . 232 = 22,02 mol
%Al = 37% và %Fe3O4 = 63%
Đáp án A





2Al+6Hcl->2AlCl3+3H2
x-----------------x--------3\2x
Fe+2HCl->FeCl2+H2
y-----------------y------y
Ta có :
\(\left\{{}\begin{matrix}27x+56y=9,65\\\dfrac{3}{2}x+y=0,325\end{matrix}\right.\)
=>x=0,15 mol, y=0,1 mol
=>m Al=0,15.27=4,05g
=>m Fe=56.0,1=5,6g
b)
=>m AlCl3=0,15.133,5=20,025g
=>m FeCl2=0,1.127=12,7g
\(\left\{{}\begin{matrix}Al\\Fe\end{matrix}\right.+HCl->\left\{{}\begin{matrix}AlCl3\\FeCl2\end{matrix}\right.+7,28lH2\)
a,
Ta có :
\(\left\{{}\begin{matrix}27x+56y=9,65\\3x+2y=0,65\left(bt-e\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}x=0,15\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}mAl=0,15.27=4,05\left(g\right)\\mFe=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
b,
Bảo toàn nguyên tố :
nAl = nAlCl3 = 0,15 ( mol )
nFe = nFeCl2 = 0,1 ( mol )
Khối lượng chất tan A :
m = 0,15 . 133,5 + 0,1 . 127 = 32,725(g)