Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Trong 300 ml dung dịch X có m gam Al 2 SO 4 3 , suy ra trong 150 ml dung dịch X sẽ có 0,5m gam Al 2 SO 4 3 và có số mol là x.
Lượng Al 2 SO 4 3 phản ứng ở 2 thí nghiệm là như nhau. Lượng OH - ở TN2 nhiều hơn ở TN1, lượng kết tủa (y mol) ở TN2 ít hơn ở TN1 (2y mol). Chứng tỏ ở TN2 kết tủa Al OH 3 đã bị hòa tan một phần, ở TN1 kết tủa có thể bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 kết tủa Al OH 3 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
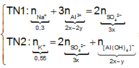
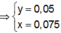
![]() thỏa mãn
thỏa mãn
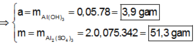
● Ở TN1 kết tủa Al OH 3 đã bị hòa tan, áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có:
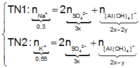
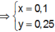
![]() (loại) (*)
(loại) (*)
PS : Nếu không sử dụng biểu thức (*) để biện luận loại trường hợp không thỏa mãn thì sẽ tính ra đáp án B. Nhưng đó là kết quả sai.


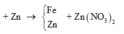
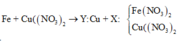
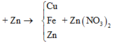
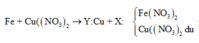
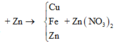
Theo định luật bảo toàn khối lượng, ta có:

![]()
![]()
tìm được m = 4,48 (g)
Đáp án A

Đáp án B
Phản ứng chỉ tạo 1 sản phẩm khử của N+5 mà cho KOH + X thu được khí => Chứng tỏ sản phẩm khử là NH3 và NH4NO3. Na phản ứng với HNO3 có tạo thành khí H2
8 Na + 10 HNO 3 → 8 NaNO 3 + NH 4 NO 3 + 3 H 2 O x 0 , 125 x mol 2 Na + 2 H 2 O → 2 NaOH + H 2 y y 0 , 5 y mol NaOH + NH 4 NO 3 → NH 3 + NaNO 3 + H 2 O y y y ⇒ 0 , 5 y + y = 0 , 336 22 , 4 = 0 , 015 ⇒ y = 0 , 01 KOH + NH 4 NO 3 → NH 3 + KNO 3 + H 2 O ( 0 , 125 x - 0 , 01 ) → ( 0 , 125 x - 0 , 01 ) ⇒ 0 , 125 x - 0 , 01 = 0 , 224 22 , 4 ⇒ x = 0 , 16 ⇒ = 23 ( x + y ) = 3 , 91 gam

Đáp án C
0,3 mol NaOH phản ứng với dung dịch Y: cuối cùng Natri đi về đâu?
À, trong 0,15 mol NaCl (bảo toàn Cl) và còn lại là 0,15 mol trong NaNO3.
Nhẩm nhanh ở phản ứng Fe + HNO3 → 0,006 mol NO
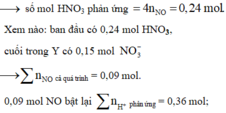
mà tổng HNO3 ban đầu với HCl thêm vào là 0,39 mol.
→ Chứng tỏ rằng trong Y còn dư 0,03 mol H+ nữa.
Rõ hơn quan sát sơ đồ tổng:
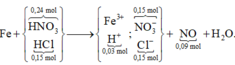
Áp dụng định luật bảo toàn điện tích trong dung dịch Y → số mol Fe là 0,09 mol
→ m = 5,04 gam.

n H 2 S O 4 = 0 , 05 m o l ; n N a O H = 0 , 1 m o l ; n K O H = 0 , 175 m o l
Coi hỗn hợp Y gồm valin (x mol), Gly-Ala (y mol) và H 2 S O 4 0 , 05 m o l chưa phản ứng với nhau
Vì Y phản ứng vừa đủ với dung dịch Z nên :
n V a l + 2 n G l y − A l a + 2 n H 2 S O 4 = n N a O H + n K O H → x + 2 y + 0 , 05.2 = 0 , 1.1 + 0 , 1.1 , 75 1
Trong dung dịch Z chứa các ion:
H 2 N − C 4 H 8 − C O O − V a l : x m o l
H 2 N − C H 2 − C O O − G l y : y m o l
H 2 N − C 2 H 4 C O O − A l a : y m o l
S O 4 2 − : 0 , 05 m o l ; N a + : 0 , 1 m o l ; K + : 0 , 175 m o l
→ m m u o i = 116 x + 74 + 88 y + 0 , 05.96 + 0 , 1.23 + 0 , 175.39 = 30 , 725 2
Từ (1) và (2) → x = 0,075 mol; y = 0,05
→ a = x + y = 0,125 mol
Đáp án cần chọn là: B
Chú ý
+ tính nhầm a = x + 2y → chọn nhầm đáp án D

Đáp án B
0,03 mol Ag + V ml AgNO3 0,7M → NO↑
CM AgNO3 = CM HNO3 dư
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
nHNO3phản ứng = 0,03 : 3 × 4 = 0,04 mol.
Vì V không thay đổi nên nHNO3 dư = nAgNO3 = 0,03 mol
→ ∑nHNO3 = 0,04 + 0,03 = 0,07 mol
→ VHNO3 = 0,07 : 0,7 = 0,1 lít = 100 ml

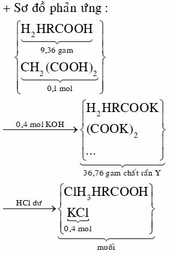


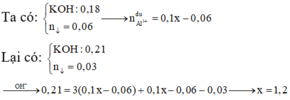

Đáp án B.