Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

-Vì khối lượng hỗn hợp kim loại ở 2 trường hợp đều bằng nhau. Chỉ thay đổi lượng HCl. Do trường hợp 800ml HCl thì khối lượng chất rắn tăng lên nên nếu với 500ml HCl mà kim loại hết thì khi tăng lên 800ml HCl thì khối lượng chất rắn không thể tăng lên nữa nên:
-Trường hợp 500ml HCl thì hỗn hợp kim loại dư, HCl hết.
-Trường hợp 500ml HCl thì hỗn hợp kim loại hết, HCl dư.
-Ta sẽ tìm khối lượng mỗi kim loại trong trường hợp 800ml HCl:
-Gọi \(n_{Zn}=x;n_{Fe}=y\)
Zn+2HCl\(\rightarrow\)ZnCl2+H2
Fe+2HCl\(\rightarrow\)FeCl2+H2
Chất rắn thu được là ZnCl2 x mol và FeCl2 y mol
hệ: \(\left\{{}\begin{matrix}65x+56y=18,6\\136x+127y=39,9\end{matrix}\right.\)
giải ra x=0,2 và y=0,1
mZn=65.0,2=13gam; mFe=56.0,1=5,6gam
-Tính nồng độ mol HCl theo trường hợp 500ml HCl vì HCl phản ứng hết.
Cứ 1 mol hỗn hợp kim loại tạo 1 mol hỗn hợp muối thì tăng 71 gam
Vậy x mol hỗn hợp kim loại tạo x mol hỗn hợp muối thì tăng 34,575-18,6=15,975 gam
\(\rightarrow x=\dfrac{15,975}{71}=0,225mol\)
\(\rightarrow n_{HCl}=2x=0,45mol\rightarrow C_{M_{HCl}}=\dfrac{0,45}{0,5}=0,9M\)
Ngoài ra còn có thể tính cách khác nữa!bạn tự tham khảo nhé!

Do tính khử Zn > Fe nên Zn phản ứng trước.
Do khối lượng rắn khan ở thí nghiệm 2 > thí nghiệm 1.
Do đó, ở thí nghiệm 1 HCl hết, kim loại có thể dư. Ở thí nghiệm 2, kim loại hết, HCl có thể dư.
\(Zn + 2HCl \to ZnCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{Zn} = a ; n_{Fe} = b\\ m_A = 65a + 56b = 18,6\\ m_{chất\ rắn} = 136a + 127b = 39,9\\ \Rightarrow a = 0,2; b = 0,1\\ \Rightarrow m_{Zn} = 0,2.65 = 13(gam) ; m_{Fe} = 0,1.56 = 5,6(gam)\)
Thí nghiệm 1 :
\(n_{Fe\ pư} = x(mol) ; n_{Fe\ dư} = y(mol)\\ \Rightarrow x + y = 0,1(1)\\ n_{FeCl_2} = x (mol)\\ \Rightarrow m_{chất\ rắn} = 0,2.136 + 127x + 56y = 34,575(2)\\ (1)(2)\Rightarrow x = 0,025 ; y = 0,075\\ n_{HCl} = 2n_{Zn} + 2n_{Fe\ pư} = 0,2.2 + 0,025.2 = 0,45(mol)\\ C_{M_{HCl}} = \dfrac{0,45}{0,5} = 0,9M\)

Thí nghiệm 1 :
\(m_{Cl} = m_{muối} - m_{kim\ loại} = 5,82-2,98 = 2,84(gam)\\ \Rightarrow n_{HCl} = n_{Cl} = \dfrac{2,84}{35,5} = 0,08(mol)\\ \Rightarrow C_{M_{HCl}} = \dfrac{0,08}{0,2} = 0,4M\)
Thí nghiệm 2 :
\(\left\{{}\begin{matrix}Fe:a\left(mol\right)\\Zn:b\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\) 56a + 65b = 2,98(1)
\(\left\{{}\begin{matrix}FeCl_2:a\left(mol\right)\\ZnCl_2:b\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\) 127a + 136b = 6,53(2)
(1)(2) suy ra: a = 0,03 ; b = 0,02
Vậy :
\(\%m_{Fe} = \dfrac{0,03.56}{2,98}.100\% = 56,38\%\\ \%m_{Zn} = 100\% -56,38\% = 43,62\%\)


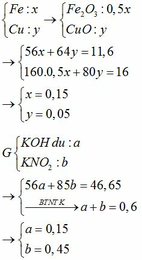
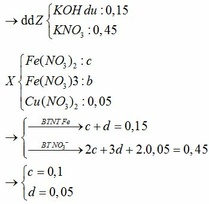

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

M + 2HCl → MCl2 + H2↑
MO + 2HCl → MCl2 + H2O
MCl2 + 2NaOH → M(OH)2↓ + 2NaCl
M(OH)2 → MO + H2O
M + CuCl2 → MCl2 + Cu↓






Gọi n Zn = a (mol) ; n Fe = b (mol)
m A = 65a +56b = 18.6 (g) (1)
Lần 2:
PTHH : Zn + 2HCl --> ZnCl2 + H2
mol: a 2a a
PTHH : Fe + 2HCl --> FeCl2 + H2
mol: b 2b b
m rắn = 136a + 127b = 39.9 (3)
Giải hệ (1), (2) và (3): a = 0.2 (mol)
b = 0.1 (mol)
Tổng số mol HCl = 2*0.2+2*0.1 = 0,6 (mol)
CMHCl = \(\dfrac{0.6}{0.8}\) = 0.75 (M)
m Zn = 0.2*65 = 13 (g)
m Fe = 0.1*56 = 5.6 (g)
Bạn xem lại đầu bài bài đi nhé xem lần 1 có sai gì không, mình mới làm phần hai thôi.
làm theo cách bạn thì có lẽ đã bỏ qua hai dữ liệu bài cho là 34,575g chất rắn khi cho HCl vào thí nghiệm 1và dư cả 39,9 g chất rắn khi vào HCl thí nghiệm 2