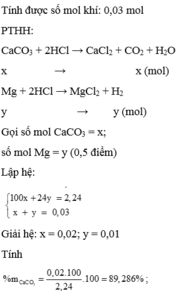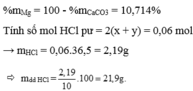Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Gọi \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
\(n_{H_2}=\dfrac{7,28}{22,4}=0,35\left(mol\right)\)
PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
a--------------------------------------->1,5a
Zn + H2SO4 ---> ZnSO4 + H2
b------------------------------>b
Theo bài ra, ta có hệ: \(\left\{{}\begin{matrix}27a+65b=10,55\\1,5a+b=0,35\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,15\left(mol\right)\\b=0,1\left(mol\right)\end{matrix}\right.\left(TM\right)\)
\(\rightarrow\left\{{}\begin{matrix}m_{Al}=0,15.27=4,05\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{4,05}{10,55}.100\%=38,4\%\\\%m_{Zn}=100\%-38,4\%=61,6\%\end{matrix}\right.\)
b, PTHH:
\(Zn+2H_2SO_{4\left(đặc,nguội\right)}\rightarrow ZnSO_4+SO_2\uparrow+2H_2O\)
0,1------------------------------>0,1----->0,1
\(2Al+3ZnSO_4\rightarrow Al_2\left(SO_4\right)_3+3Zn\downarrow\)
\(\dfrac{1}{15}\)<---0,1---------->\(\dfrac{1}{30}\)---------->0,1
\(Zn+2H_2SO_{4\left(đặc,nguội\right)}\rightarrow ZnSO_4+SO_2\uparrow+2H_2O\)
0,1----------------------------->0,1-------->0,1
\(\rightarrow\left\{{}\begin{matrix}V=\left(0,1+0,1\right).22,4=4,48\left(l\right)\\x=\dfrac{1}{30}.342+0,1.161=27,5\left(g\right)\end{matrix}\right.\)
\(a.Đặt:\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Zn}=y\left(mol\right)\end{matrix}\right.\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ \Rightarrow\left\{{}\begin{matrix}27x+65y=10,55\left(g\right)\\\dfrac{3}{2}x+y=\dfrac{7,28}{22,4}=0,325\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,15\\y=0,1\end{matrix}\right.\\ \%m_{Al}=\dfrac{0,15.27}{10,55}.100=38,39\%;\%m_{Zn}=61,61\%\\ b.X+H_2SO_4đặc,nguội\Rightarrow ChỉcóZnphảnứng\\ Zn\rightarrow Zn^{2+}+2e\\ S^{+6}+2e\rightarrow S^{+4}\\ Bảotoàne:n_{Zn}.2=n_{SO_2}.2\\ \Rightarrow n_{SO_2}=0,1\left(mol\right)\\ \Rightarrow V_{SO_2}=0,1.22,4=2,24\left(l\right)\\ n_{ZnSO_4}=n_{Zn}=0,1\left(mol\right)\\ \Rightarrow m_{ZnSO_4}=161.0,1=16,1\left(g\right)\)
Lưu ý: Al bị thụ động với H2SO4 dặc nguội

n O = 10.24%/16 = 0,15(mol)
Quy đổi X gồm n Fe = a(mol) ; n S = b(mol) ; n O = 0,15(mol)
=> 56a + 32b + 0,15.16 = 10(1)
n SO2 = 1,68/22,4 = 0,075(mol)
Bảo toàn electron :
3a + 6b = 0,15.2 + 0,075.2(2)
Từ (1)(2) suy ra a = 0,13 ; b = 0,01
Gọi n O2 = n O3 = x(mol)
Bảo toàn electron :
4n O2 + 6n O3 + 2n O = 3n Fe + 4n S
<=> 4x + 6x + 0,15.2 = 0,13.3 + 0,01.4
<=> x = 0,013
=> V = (0,013 + 0,013).22,4 = 0,5824 lít

Zn+2HCl→ZnCl\(_2\)+H\(_2\)
0,1 0,2 0,1(mol)
ZnO+2HCl→ZnCl\(_2\)+H\(_2\)O
0,05 0,1 (mol)
n\(H_2\)=\(\dfrac{2,24}{22,4}\)=0,1(mol)
m\(_{Zn}\)=0,1.65=6,5(g)
m\(_{ZnO}\)=10,55-6,5=4,05(g)
b/
n\(_{HCl}\)=0,1+0,2=0,3(mol)
m\(_{HCl}\)=0,3.36,5=10,95(g)
m\(_{dd_{HCl}}\)=\(\dfrac{100.10,95}{10}\)=109,5(g)
n\(_{ZnO}\)=\(\dfrac{4,05}{81}\)=0,05(mol)
cho mình hỏi tại sao HCl ở pt dưới ra được 0,1 mol vậy..

1.
a, \(2Fe+3Cl_2\underrightarrow{^{to}}2FeCl_3\)
\(m_{FeCl_3}=\frac{16,25.100}{100}=16,25\left(g\right)\)
b, \(n_{FeCl_3}=\frac{16,25}{162,5}=0,1\left(mol\right)\)
\(\rightarrow n_{Fe}=n_{FeCl_3}=0,1\left(mol\right)\)
\(\rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(n_{CL2}=\frac{3}{2}n_{FeCl3}=0,15\left(mol\right)\)
\(\rightarrow V_{CL2}=0,15.22,4=3,36\left(l\right)\)
Bài 2 :
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
\(n_{H2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
\(\rightarrow n_{Zn}=n_{H2}=0,1\left(mol\right)\)
\(m_{Zn}=0,1.65=6,5\left(g\right),m_{ZnO}=10,55-6,5=4,05\left(g\right)\)
b)
\(n_{ZnO}=\frac{4,05}{81}=0,05\left(mol\right)\)
\(n_{HCl}=0,05.2+0,1.2=0,3\left(mol\right)\)
\(\rightarrow m_{dd_{HCl}}=\frac{0,3.36,5}{10\%}=109,5\left(g\right)\)
Bài 3 : Xem lại đề
Bài 4:
a)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{HCl}=0,25.2=0,5\left(mol\right)\)
Gọi a là số mol Fe b là số mol Zn
Giải hệ phương trình :
\(\left\{{}\begin{matrix}56a+65b=14,9\\2a+2b=0,5\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,15\\b=0,1\end{matrix}\right.\)
\(\%m_{Fe}=\frac{0,15.56}{14,9}.100\%=56,38\%,\%m_{Zn}=100\%-56,38\%=43,62\%\)
b)
\(n_{H2}=\frac{n_{HCl}}{2}=\frac{0,5}{2}=0,25\left(mol\right)\)
\(\rightarrow V_{H2}=0,25.22,4=5,6\left(l\right)\)
Bài 5 :
m tăng thêm=mKl-mH2
\(\rightarrow m_{H2}=7,8-7=0,8\left(g\right)\)
\(\rightarrow n_{H2}=\frac{0,8}{2}=0,4\left(mol\right)\)
Gọi a là số mol Al b là số mol Mg
Giải hệ phương trình :
\(\left\{{}\begin{matrix}27a+24b=7,8\\1,5a+b=0,4\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(m_{Al}=0,2.27=5,4\left(g\right),m_{Mg}=0,1.24=2,4\left(g\right)\)