Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{H_2SO_4}=0,3.1=0,3\left(mol\right)\)
Gọi CTHH của oxit bazo đó là A2O3.
PT: \(A_2O_3+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2O\)
Theo PT: \(n_{A_2O_3}=\dfrac{1}{3}n_{H_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow M_{A_2O_3}=\dfrac{10,2}{0,1}=102\left(g/mol\right)\)
⇒ 2MA + 16.3 = 102 ⇒ MA = 27 (g/mol)
→ A là Al.
Vậy: CTHH cần tìm là Al2O3.

Gọi công thức hóa học của oxit là RO
→Phương trình hóa học: RO+2HCl→RCl2+H2O
nRO:8,1\(R+16nRO)= nRCl2: 13,6\R+35,5.2
⇔ 8,1.(R+71)=13,6.(R+16)
⇔ 8,1R+575,1=13,6R+217,6
⇔ 8,1R−13,6R=−575,1+217,6
⇔ −5,5R=−357,5
⇔ R=65 (Zn)
→ R là nguyên tố Kẽm (Zn)
công thức hóa học: ZnO

\(n_A=x\left(mol\right)\\ n_{A_2O}=y\left(mol\right)\)
\(m_{hh}=xA+y\left(2A+16\right)=32.4\left(g\right)\)
\(\Rightarrow Ax+2Ay+16y=32.4\)
\(\Rightarrow A\left(x+2y\right)+16y=32.4\left(1\right)\)
\(n_{H_2SO_4}=\dfrac{58.8}{98}=0.6\left(mol\right)\)
\(A+H_2O\rightarrow AOH+\dfrac{1}{2}H_2\)
\(A_2O+H_2O\rightarrow2AOH\)
\(n_{AOH}=x+2y\left(mol\right)\)
\(2AOH+H_2SO_4\rightarrow A_2SO_4+H_2O\)
\(1.2..............0.6\)
\(\Rightarrow x+2y=1.2\left(2\right)\left(0\le y\le0.6\right)\)
\(\text{Thay}\left(2\right)\text{vào }\left(1\right):\)
\(1.2A+16y=32.4\)
\(\Rightarrow16y=32.4-1.2A\)
\(\Rightarrow y=\dfrac{32.4-1.2A}{16}\)
\(0\le y\le0.6\)
\(\Leftrightarrow0\le\dfrac{32.4-1.2A}{16}\le0.6\)
\(\Leftrightarrow19\le A\le27\)
\(A=23\)
\(A:Na.Oxit:Na_2O\)

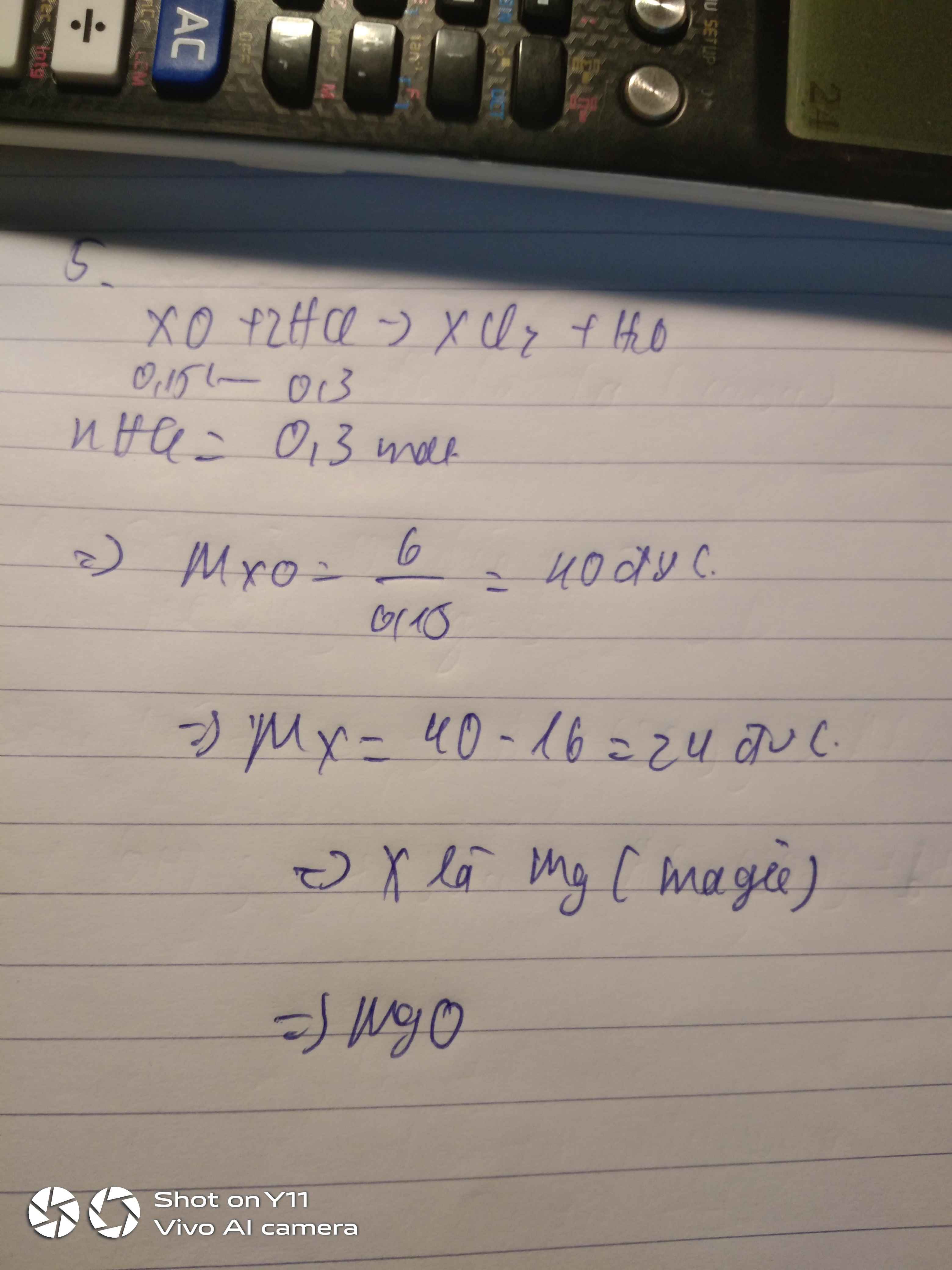


PTHH: \(RO+H_2SO_4\rightarrow RSO_4+H_2O\)
Ta có: \(n_{RO}=n_{H_2SO_4}\)
\(\Rightarrow\dfrac{20}{R+16}=\dfrac{24,5}{98}\) \(\Rightarrow R=64\) (Đồng)
Vậy CTHH của oxit là CuO