Dựa vào xu hướng biến đổi tính acid - base của oxide và hydroxide tương ứng của các nguyên tố trong bảng tuần hoàn, hãy sắp xếp các hợp chất sau đây theo chiều giảm dần tính acid của chúng: H2SiO3, HClO4, H2SO4, H3PO4.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Để so sánh được tính acid và base của các oxide và hydroxide dựa vào vị trí nguyên tố tạo nên chúng trong bảng tuần hoàn nguyên tố hóa học cần ghi nhớ:
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.

Ví dụ: Nguyên tố X thuộc chu kì 3, nhóm VIIA.
⇒ Nguyên tử X có 3 lớp electron và 7 electron lớp ngoài cùng.
⇒ Cấu hình electron của X là 1s2 2s2 2p6 3s2 3p5.
- Do có 7 electron lớp ngoài cùng nên nguyên tố X là phi kim.
- Công thức oxide ứng với hóa trị cao nhất là X2O7 là acidic oxide.
- Công thức hydroxide ứng với hóa trị cao nhất là HXO4 là acid mạnh.

- Trong 1 chu kì:
+ Tính kim loại giảm dần, tính phi kim tăng dần.
+ Tính base của oxide, hydroxide giảm dần; tính acid của oxide, hydroxide tăng dần

- Để so sánh được xu hướng biến đổi một số tính chất của các nguyên tố, ta cần nắm được: Theo chiều tăng của điện tích hạt nhân nguyên tử:
+ Bán kính nguyên tử: giảm dần trong một chu kì, tăng dần trong một nhóm A.
+ Độ âm điện: tăng dần trong một chu kì, giảm dần trong một nhóm A.
+ Tính kim loại: giảm dần trong một chu kì, tăng dần trong một nhóm A.
+ Tính phi kim: tăng dần trong một chu kì, giảm dần trong một nhóm A.
- Giải thích:
+ Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng. Bán kính giảm là do lực hút tăng và ngược lại, bán kính tăng do lực hút giảm.
+ Độ âm điện phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng.
+ Tính kim loại và phi kim phụ thuộc vào bán kính và lực hút giữa hạt nhân với các electron lớp ngoài cùng.

- Na, Mg thuộc cùng chu kì 2
- Na, K thuộc cùng nhóm IA
- Trong cùng 1 chu kì, tính theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm dần => Tính kim loại Na > Mg (1)
- Trong cùng 1 nhóm, tính theo chiều tăng dần điện tích hạt nhân, tính kim loại tăng dần => Tính kim loại K > Na (2)
- Từ (1) và (2)
=> Sắp xếp các nguyên tố theo chiều giảm dần tính kim loại: K > Na > Mg

Theo chiều tăng của điện tích hạt nhân nguyên tử:
- Trong một chu kì; độ âm điện của nguyên tử các nguyên tố thường tăng dần, năng lượng ion hóa tăng dần, bán kính nguyên tử giảm dần.
- Trong một nhóm; độ âm điện của nguyên tử các nguyên tố giảm dần, năng lượng ion hóa giảm dần, bán kính nguyên tử tăng.
→ Tính chất không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân các nguyên tố trong bảng tuần hoàn là nguyên tử khối.
→ Chọn A.

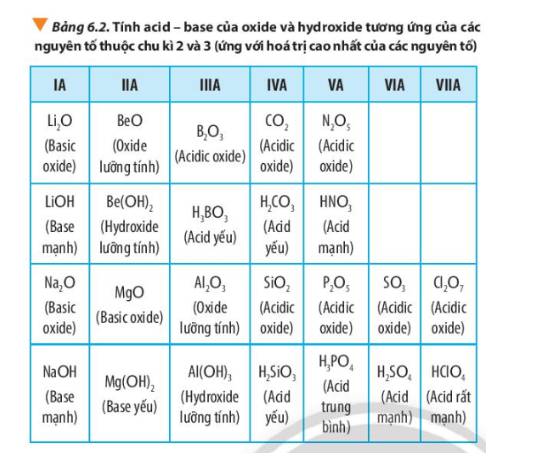

- Trong cùng 1 chu kì, tính từ trái trang phải, tính acid của hydroxide tương ứng của các nguyên tố trong bảng tuần hoàn tăng dần
=> Sắp xếp theo chiều giảm dần tính acid: HClO4 > H2SO4 > H3PO4 > H2SiO4
Trong cùng 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, tính acid của hydroxide tương ứng của các nguyên tố trong bảng tuần hoàn tăng dần.
⇒ Chiều giảm dần tính acid: HClO4 > H2SO4 > H3PO4 > H2SiO3.