Hoà tan hoàn toàn 1,44g kim loại có hoá trị 2 vào 250ml dd H2SO4 0,3 M, sau đó thêm tiếp 60ml dd KOH 0,5M để trung hoà hết lượng axit còn dư .Kim loại ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{NaOH}=0.06\cdot0.5=0.03\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=\dfrac{0.03}{2}=0.015\left(mol\right)\)
\(n_{H_2SO_4\left(pư\right)}=0.25\cdot0.3-0.015=0.06\left(mol\right)\)
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
\(0.06....0.06\)
\(M_R=\dfrac{1.44}{0.06}=24\left(\dfrac{g}{mol}\right)\)
\(R:Mg\)

Gọi kim loại là M
M + H2SO4 ---> MSO4 + H2 (1)
H2SO4 + 2NaOH ---> Na2SO4 + 2H2O (2)
Số mol H2SO4 ban đầu = 0,5.0,15 = 0,075 mol; số mol H2SO4 dư = 1/2 số mol NaOH = 0,5.1.0,03 = 0,015 mol. Số mol H2SO4 phản ứng (1) = 0,075 - 0,015 = 0,06.
số mol muối MSO4 = số mol H2SO4 p.ư (1) nên: M + 96 = 7,2/0,06 = 120. Vậy: M = 24 (Mg).

nH2SO4 bđ = 0,3 . 0,25 = 0,075 mol
nNaOH = 0,5 . 0,06 = 0,03 mol
Pt: A + H2SO4 --> ASO4 + H2
....0,06<-0,06
.....2NaOH + H2SO4 --> Na2SO4 + 2H2O
....0,03 mol-> 0,015 mol
nH2SO4 còn = 0,075 - 0,015 = 0,06 mol
Ta có: 1,44 = 0,06.MA
=> MA = \(\dfrac{1,44}{0,06}=24\)
=> A là Magie (Mg)

R+H2SO4->R2(SO4)n+H2(1)
H2SO4+2NaOH->Na2SO4+2H2O(2)
nNaOH=0,06.0,5=0,03(mol)
->nH2SO4 dư sau phản ứng (1)=0,03/2=0,015(mol)
Mà nH2SO4 ban đầu =0,25.0,3=0.075 mol
->nH2SO4 cần cho phản ứng (1) =0,075-0,015=0,06(mol)
->nR=nH2SO4=0,06
->MR=1,44/0,06=24(Mg)

Ta có : \(n_{H2SO4}=0,5.0,06=0,03\left(mol\right)\)
\(\Rightarrow n_{NaOH}=0,06.1=0,06\left(mol\right)\)
\(PTHH:X+H2SO4\rightarrow XSO4+H2\left(1\right)\)
\(H2SO4+2NaOH\rightarrow Na2SO4+H2O\left(2\right)\)
\(\Rightarrow MX=\frac{1,14}{0,06}=24\left(Mg\right)\)
\(\)
. M + H2SO4 --> MSO4 + H2 (1)
H2SO4 + 2NaOH --> NA2SO4 + 2H2O (2)
nH2SO4 = 0.03 mol
nNaOH = 0.06 mol
nM = 0.06 => M = 1.44/0.06 = 24 =>M là Mg

Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
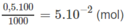
Số mol NaOH trong 33,4 ml nồng độ 1M :
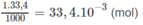
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :

Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: 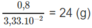
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.


Gọi kim loại cần tìm là R
\(n_{H_2SO_4}=0,25.0,3=0,075\left(mol\right)\)
\(n_{KOH}=0,06.0,5=0,03\left(mol\right)\)
PTHH: R + H2SO4 --> RSO4 + H2
0,06<--0,06
2KOH + H2SO4 --> K2SO4 + 2H2O
0,03-->0,015
=> \(M_R=\dfrac{1,44}{0,06}=24\left(g/mol\right)\)
=> R là Mg
Số mol H2SO4 và KOH lần lượt là 0,3.0,25=0,075 (mol) và 0,5.0,06=0,03 (mol).
Số mol H2SO4 phản ứng là (0,075.2-0,03):2=0,06 (mol) và bằng số mol của kim loại ban đầu.
Nguyên tử khối của kim loại cần tìm là 1,44:0,06=24 (g/mol).
Vậy kim loại đã cho là magie (Mg).