Cho 10,8 gam kim loại A hoá trị III tác dụng với dung dịch axit sunfuric H2SO4 dư, sau phản ứng thu được sản phẩm B là hợp chất tạo bởi A và nhóm sunfat, ngoài ra còn có 13,44 lít khí (ở đktc).
a/ Xác định kim loại A.
b/ Tính khối lượng chất B thu được.




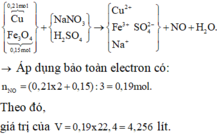
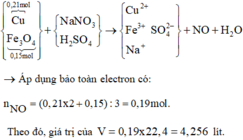

a)
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: \(2A+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2\)
=> \(n_A=0,4\left(mol\right)\)
=> \(M_A=\dfrac{10,8}{0,4}=27\left(g/mol\right)\)
=> A là Al
b) \(n_{Al_2\left(SO_4\right)_3}=0,2\left(mol\right)\)
=> \(m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4\left(g\right)\)
lô thái