Nung m gam hỗn hợp A gồ KMnO4 và KClO3 thu được chất rắn B và khí oxi, lúc đó KClO3 bị phân hủy hoàn toàn còn KMnO4 bị phân hủy không hoàn toàn. Trong B có 0,894 gam KCl chiếm 8,132% khối lượng. Trộn lượng oxi ở trên với không khí theo tỉ lệ thể tích 1:3 trong bình kín thu được hỗn hợp khí X. Cho vào bình 0,528 gam cacbon rồi đốt cháy hết cacbon thu được hỗn hợp khí Y gồm 3 khí trong đó CO2 chiếm 22,92% thể tích. Tính m.(Coi không khí gồm 20% thể tích là oxi còn lại là nitow).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH.
2KClO3 to 2KCl + 3O2 (1)
2KMnO4 to K2MnO4 + MnO2 + O2 (2)
Gọi a là tổng số mol õi tạo ra ở PT(1) và (2), sau khi trộn với không khí ta có trong hỗn hợp X.
nO2= a+ 3a.20%= 1,6a (mol).
nN2= 3a.80% = 2,4a (mol).
Ta có nC= 0,528/12= 0,044 mol
mB= 0,894.100/8,132= 10,994 gam
Theo đề cho trong Y có 3 khí nên xảy ra 2 trươnhg hợp;
Trường hợp 1: Nếu oxi dư, lúc đó các bon cháy theo phản ứng:
C + O2 to CO2 (3)
Tổng số mol khí Y: nY= 0,044.100/22,92= 0,192 mol gồm các khí O2 dư, N2, CO2
Theo PT(3): nO2pư= nC= 0,044 mol
nCO2= nC= 0,044 mol
nO2dư= 1,6- 0,044
nY= 1,6a- 0,044 + 2,4 + 0,044 = 0,192
Giải ra: a= 0,048, mO2 = 0,048.32= 1,536 gam.
Theo đề ta có: mA= mB+ mO2 = 10,944 + 1,536 = 12,53 gam.
Trường hợp 2: Nếu oxi thiếu, lúc đó các bon cháy theo phản ứng:
C + O2 to CO2 (3)
C + O2 to 2CO (4)
Gọi b là số mol CO2 tạo thành, theo PT(3),(4): nCO= 0,044- b
nO2= b+ 0,044-b/2 = 1,6 a
Y gồm N2, CO2, CO và nY= 2,4a + b+ 0,044- b = 2,4 a+ 0,044
%CO2 = b/2,4+ 0,044= 22,92/100
Giải ra: a= 0,204 mol, mO2= 0,204.32= 0,6528 gam
Vậy: mA= mB+ mO2 = 10,944 + 0,6528 = 11,6468 gam gam.

\(m_B=\dfrac{0,894}{8,132\%}=11\left(g\right)\)
\(n_C=\dfrac{0,528}{12}=0,44\left(mol\right)\)
Đặt \(n_{O_2}=a\left(mol\right)\)
\(\rightarrow n_{kk}=3a\left(mol\right)\rightarrow\left\{{}\begin{matrix}n_{O_2}=\dfrac{20}{100}.3a=0,6a\left(mol\right)\\n_{N_2}=3a-0,6a=2,4a\left(mol\right)\end{matrix}\right.\)
Vậy khí X gồm: \(\left\{{}\begin{matrix}O_2:n_{O_2}=a+0,6a=1,6a\left(mol\right)\\N_2:n_{N_2}=2,4a\left(mol\right)\end{matrix}\right.\)
+) TH1: Khí Y gồm CO2, N2, O2(dư)
PTHH: \(C+O_2\xrightarrow[]{t^o}CO_2\)
0,044-->0,044->0,044
\(\rightarrow\left\{{}\begin{matrix}n_{O_2\left(dư\right)}=1,6x-0,044\left(mol\right)\\n_Y=\dfrac{0,044}{22,92\%}=0,2\left(mol\right)\end{matrix}\right.\)
Theo bài ra, ta có PT:
\(2,4a+0,044+16,a-0,044a=0,2\\ \Leftrightarrow a=0,05\left(mol\right)\)
Áp dụng ĐLBTKL:
\(m_A=m_B+m_{O_2}=11+0,05.32=12,6\left(g\right)\)
+) TH2: khí Y gồm CO2, N2, CO
PTHH: \(C+O_2\xrightarrow[]{t^o}CO_2\)
1,6a<-1,6a-->1,6a
\(\rightarrow n_{C\left(dư\right)}=0,044-1,6a\left(mol\right)\)
PTHH: \(C+CO_2\xrightarrow[]{t^o}2CO\)
(0,044-1,6a)->(0,044-1,6a)->(0,088-3,2a)
\(\rightarrow n_{CO_2}=1,6a-\left(0,044-1,6a\right)=3,2a-0,044\left(mol\right)\)
\(\rightarrow n_Y=2,4a+3,2a-0,044+0,088-3,2a=2,4a+0,044\)
Theo bài ra, ta có PT:
\(\dfrac{3,2a-0,044}{2,4a+0,044}.100\%=22,92\%\\ \Leftrightarrow a=0,02\left(mol\right)\)
Áp dụng ĐLBTKL:
\(m_A=m_B+m_{O_2}=11+0,02.32=11,64\left(g\right)\)

PTHH.
2KClO3 to 2KCl + 3O2 (1)
2KMnO4 to K2MnO4 + MnO2 + O2 (2)
Gọi a là tổng số mol õi tạo ra ở PT(1) và (2), sau khi trộn với không khí ta có trong hỗn hợp X.
nO2= a+ 3a.20%= 1,6a (mol).
nN2= 3a.80% = 2,4a (mol).
Ta có nC= 0,528/12= 0,044 mol
mB= 0,894.100/8,132= 10,994 gam
Theo đề cho trong Y có 3 khí nên xảy ra 2 trươnhg hợp;
Trường hợp 1: Nếu oxi dư, lúc đó các bon cháy theo phản ứng:
C + O2 to CO2 (3)
Tổng số mol khí Y: nY= 0,044.100/22,92= 0,192 mol gồm các khí O2 dư, N2, CO2
Theo PT(3): nO2pư= nC= 0,044 mol
nCO2= nC= 0,044 mol
nO2dư= 1,6- 0,044
nY= 1,6a- 0,044 + 2,4 + 0,044 = 0,192
Giải ra: a= 0,048, mO2 = 0,048.32= 1,536 gam.
Theo đề ta có: mA= mB+ mO2 = 10,944 + 1,536 = 12,53 gam.
Trường hợp 2: Nếu oxi thiếu, lúc đó các bon cháy theo phản ứng:
C + O2 to CO2 (3)
C + O2 to 2CO (4)
Gọi b là số mol CO2 tạo thành, theo PT(3),(4): nCO= 0,044- b
nO2= b+ 0,044-b/2 = 1,6 a
Y gồm N2, CO2, CO và nY= 2,4a + b+ 0,044- b = 2,4 a+ 0,044
%CO2 = b/2,4+ 0,044= 22,92/100
Giải ra: a= 0,204 mol, mO2= 0,204.32= 0,6528 gam
Vậy: mA= mB+ mO2 = 10,944 + 0,6528 = 11,6468 gam gam.

Gọi a , b là số mol của KClO3 và KMnO4
TH1: Y có CO2 , N2 , O2 dư
2KClO3 ➝ 2KCl + 3O2
2KMnO4 ➝ K2MnO4 + MnO2 + O2
Gọi nO2 = x => \(\dfrac{nO_{2_{ }}}{_{ }kk}\) = 3x . 0,2 = 0,6x
nN2 = 3x.0,8 = 2,4x
C + O2 ➝ CO2
nCO2 = nC = \(\dfrac{0,528}{12}\) = 0,044
hh khí gồm : nCO2 = 0,044 ; nO2 = 1,6x - 0,044 ; nN2 = 2,4x
=> 0,044 + 1,6x - 0,044 + 2,4x = \(\dfrac{0,044.100}{22,92}\)
<=> x = 0,048
=> mhh đầu = mY + mO2 = \(\dfrac{0,894.100}{8,132}\) + 0,048.32 = 12,53
TH 2 : Y có CO , CO2 ; N2
Bảo toàn C : nCO + nCO2 = nC = 0,044 => nCO = 0,044 - nCO2
Bảo toàn O : 0,5.nCO + nCO2 = nO2 = 1,6a
⇒ 0,5.( 0,044 - nCO2 ) + nCO2 = 1,6a => nCO2 = 3,2a - 0,044
Tổng mol hh : nCO + nCO2 + nN2 = 0,044 + 2,4a
=> \(\dfrac{3,2a-0,044}{0,044+2,4a}\) = \(\dfrac{22,92}{100}\)
a ≈0.02
=> m = m rắn + mO2 = \(\dfrac{0,894.100}{8,132}\) + 0,02 . 32 = 11,646 ( g )

a)
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\) (1)
\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\) (2)
\(n_{KCl}=\dfrac{0,894}{74,5}=0,012\left(mol\right);m_B=\dfrac{0,894}{8,132\%}=11\left(g\right)\)
Gọi \(n_{O_2\left(sinh.ra\right)}=a\left(mol\right)\Rightarrow n_{kk}=3a\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{N_2}=3a.80\%=2,4a\left(mol\right)\\n_{O_2}=a+\left(3a-2,4a\right)=1,6a\left(mol\right)\end{matrix}\right.\)
\(n_C=\dfrac{0,528}{12}=0,044\left(mol\right)\)
\(C+O_2\xrightarrow[]{t^o}CO_2\) (3)
Vì hỗn hợp D gồm 3 khí và O2 chiếm 17,083%
\(\Rightarrow D:CO_2,O_{2\left(d\text{ư}\right)},N_2\)
BTNT C: \(n_{CO_2}=n_C=0,044\left(mol\right)\)
BTNT O: \(n_{O_2\left(d\text{ư}\right)}=n_{O_2\left(b\text{đ}\right)}-n_{CO_2}=1,6a-0,044\left(mol\right)\)
\(\Rightarrow\%V_{O_2}=\%n_{O_2}=\dfrac{1,6a-0,044}{1,6a-0,044+0,044+2,4a}.100\%=17,083\%\)
\(\Leftrightarrow a=0,048\left(mol\right)\left(TM\right)\)
ĐLBTKL: \(m_A=m_B+m_{O_2}=11+0,048.32=12,536\left(g\right)\)
Theo PT (2): \(n_{KClO_3}=n_{KCl}=0,012\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{KClO_3}=\dfrac{0,012.122,5}{12,536}.100\%=11,63\%\\\%m_{KMnO_4}=100\%-11,63\%=88,37\%\end{matrix}\right.\)
b) Theo PT (2): \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4\left(p\text{ư}\right)}+\dfrac{3}{2}n_{KClO_3}\)
\(\Rightarrow n_{KMnO_4\left(p\text{ư}\right)}=2.\left(0,048-\dfrac{3}{2}.0,012\right)=0,06\left(mol\right)\)
\(n_{KMnO_4\left(b\text{đ}\right)}=\dfrac{12,536-0,012.122,5}{158}=0,07\left(mol\right)\)
\(\Rightarrow n_{KMnO_4\left(d\text{ư}\right)}=0,07-0,06=0,01\left(mol\right)\)
\(n_{KCl}=\dfrac{74,5}{74,5}+0,012=1,012\left(mol\right)\)
Theo PT (1): \(n_{K_2MnO_4}=n_{MnO_2}=\dfrac{1}{2}.n_{KMnO_4\left(p\text{ư}\right)}=0,03\left(mol\right)\)
PTHH:
\(2KMnO_4+10KCl+8H_2SO_4\rightarrow6K_2SO_4+2MnSO_4+5Cl_2+8H_2O\) (4)
\(K_2MnO_4+4KCl+4H_2SO_4\rightarrow3K_2SO_4+MnSO_4+2Cl_2+4H_2O\) (5)
\(MnO_2+2KCl+2H_2SO_4\rightarrow MnSO_4+K_2SO_4+Cl_2+2H_2O\) (6)
\(2KCl+H_2SO_4\xrightarrow[]{t^o}K_2SO_4+2HCl\) (7)
Theo PT (4), (5), (6): \(n_{KCl\left(p\text{ư}\right)}=5n_{KMnO_4\left(d\text{ư}\right)}+4n_{K_2MnO_4}+2n_{MnO_2}=0,23\left(mol\right)< 1,012\left(mol\right)=n_{KCl\left(b\text{đ}\right)}\)
`=> KCl` dư
Theo PT (4), (5), (6): \(n_{Cl_2}=\dfrac{1}{2}.n_{KCl\left(p\text{ư}\right)}=0,115\left(mol\right)\)
\(\Rightarrow V_{kh\text{í}}=V_{Cl_2}=0,115.22,4=2,576\left(l\right)\)


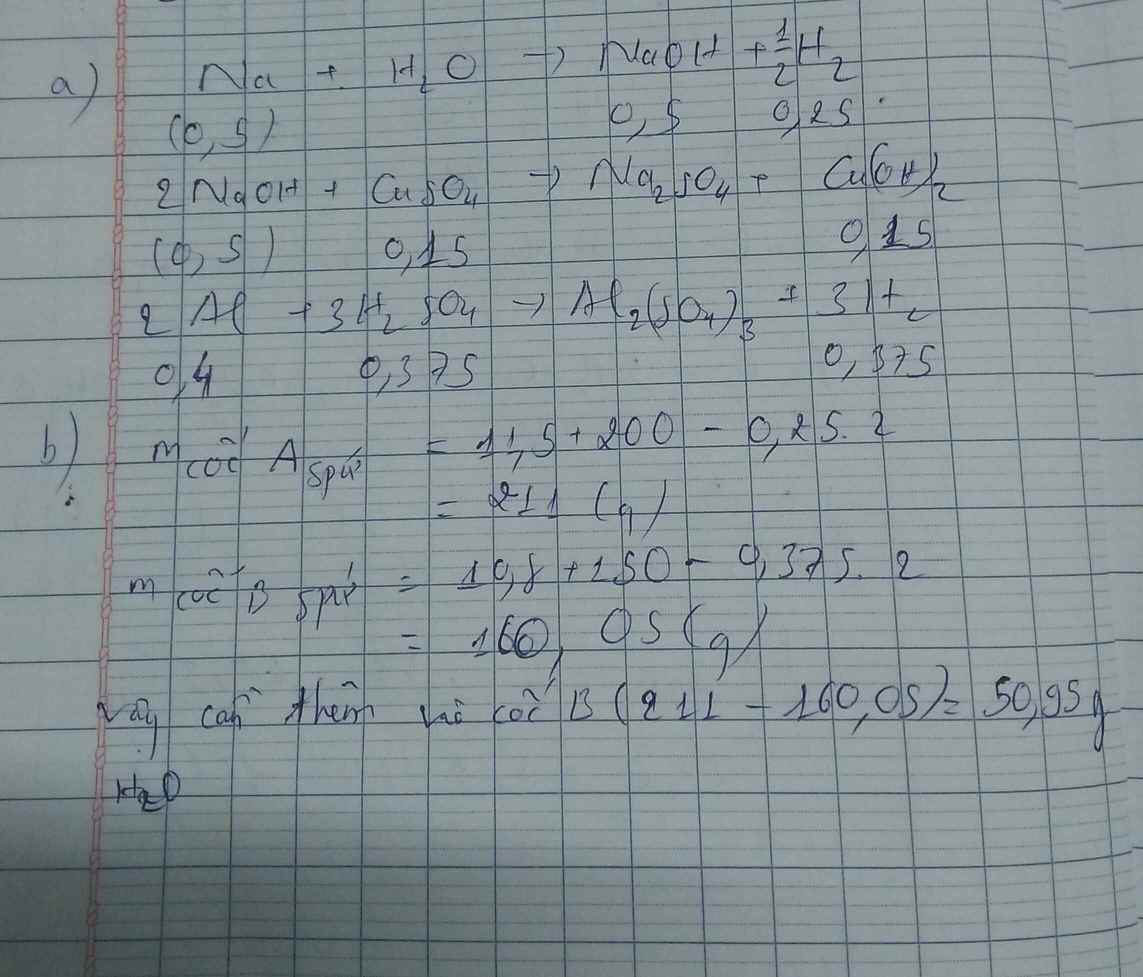

PTHH.
2KClO3 to 2KCl + 3O2 (1)
2KMnO4 to K2MnO4 + MnO2 + O2 (2)
Gọi a là tổng số mol õi tạo ra ở PT(1) và (2), sau khi trộn với không khí ta có trong hỗn hợp X.
nO2= a+ 3a.20%= 1,6a (mol).
nN2= 3a.80% = 2,4a (mol).
Ta có nC= 0,528/12= 0,044 mol
mB= 0,894.100/8,132= 10,994 gam
Theo đề cho trong Y có 3 khí nên xảy ra 2 trươnhg hợp;
Trường hợp 1: Nếu oxi dư, lúc đó các bon cháy theo phản ứng:
C + O2 to CO2 (3)
Tổng số mol khí Y: nY= 0,044.100/22,92= 0,192 mol gồm các khí O2 dư, N2, CO2
Theo PT(3): nO2pư= nC= 0,044 mol
nCO2= nC= 0,044 mol
nO2dư= 1,6- 0,044
nY= 1,6a- 0,044 + 2,4 + 0,044 = 0,192
Giải ra: a= 0,048, mO2 = 0,048.32= 1,536 gam.
Theo đề ta có: mA= mB+ mO2 = 10,944 + 1,536 = 12,53 gam.
Trường hợp 2: Nếu oxi thiếu, lúc đó các bon cháy theo phản ứng:
C + O2 to CO2 (3)
C + O2 to 2CO (4)
Gọi b là số mol CO2 tạo thành, theo PT(3),(4): nCO= 0,044- b
nO2= b+ 0,044-b/2 = 1,6 a
Y gồm N2, CO2, CO và nY= 2,4a + b+ 0,044- b = 2,4 a+ 0,044
%CO2 = b/2,4+ 0,044= 22,92/100
Giải ra: a= 0,204 mol, mO2= 0,204.32= 0,6528 gam
Vậy: mA= mB+ mO2 = 10,944 + 0,6528 = 11,6468 gam gam.