Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\) (1)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\) (2)
\(C+O_2\underrightarrow{t^o}CO_2\) (3)
Ta có: \(n_{KCl}=\dfrac{1,49}{74,5}=0,02\left(mol\right)\)
\(n_C=\dfrac{0,24}{12}=0,02\left(mol\right)\)
\(m_Y=\dfrac{1,49}{17,028\%}=8,75\left(g\right)\), Y gồm: KCl, KMnO4 (dư), K2MnO4, MnO2.
Theo PT (3): \(n_{CO_2}=n_{O_2\left(pư\right)}=n_C=0,02\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=\dfrac{0,02}{40\%}-0,02=0,03\left(mol\right)\)
⇒ ΣnO2 = 0,02 + 0,03 = 0,05 (mol)
Theo PT (1): \(n_{O_2\left(1\right)}=\dfrac{3}{2}n_{KCl}=0,03\left(mol\right)\)
\(\Rightarrow n_{O_2\left(2\right)}=0,05-n_{O_2\left(1\right)}=0,02\left(mol\right)\)
Theo PT (2): \(n_{K_2MnO_4}=n_{MnO_2}=n_{O_2\left(2\right)}=0,02\left(mol\right)\)
\(n_{KMnO_4\left(pư\right)}=2n_{O_2}=0,04\left(mol\right)\)
Mà: mKCl + mKMnO4 (dư) + mK2MnO4 + mMnO2 = 8,75
⇒ mKMnO4 (dư) = 1,58 (g) \(\Rightarrow n_{KMnO_4\left(dư\right)}=\dfrac{1,58}{158}=0,01\left(mol\right)\)
\(\Rightarrow H\%=\dfrac{0,04}{0,04+0,01}.100\%=80\%\)

a, Ta có: \(n_{O_2}=a\left(mol\right)\Rightarrow\left\{{}\begin{matrix}n_{O_{2\text{/}kk}}=0,6a\left(mol\right)\\n_{N_{2\text{/}kk}}=2,4a\left(mol\right)\end{matrix}\right.\)
Mặt khác \(n_{CO_2}=0,044\left(mol\right)\)
\(\Rightarrow\frac{\left(1,6a-0,044\right).100\%}{4a}=17,083\%\Rightarrow a\approx0,048\left(mol\right)\)
\(\Rightarrow m_A=12,536\left(g\right)\Rightarrow\left\{{}\begin{matrix}m_{KClO_3}=1,47\left(g\right)\\m_{KMnO_4}=11,066\left(g\right)\end{matrix}\right.\)
Từ đó tính %
b, Ta có \(n_{O_2\text{/}puKMnO_4}=0,03\left(mol\right)\)
Bảo toàn e ta có: \(n_{Cl_2}=\frac{5.0,07-0,03.4}{2}=0,115\left(mol\right)\)
Suy ra \(V=2,576\left(l\right)\)
ta có StgOED = \(\frac{1}{2}\)OE.ED
Đặt ED=x => OE=\(\sqrt{9-x^2}\)(Py ta :)
S=\(\frac{1}{2}x.\sqrt{9-x^2}\) = or < \(\frac{x^2+9-x^2}{4}=\frac{9}{4}\)
Dấu = xảy ra <=> x=\(\sqrt{9-x^2}\)
<=>\(^{x^2}\)=9-\(^{x^2}\)
<=>.....
<=>x=\(\frac{3}{\sqrt{2}}\)
Gọi K là hình chiếu của D
... TÍnh AC là ok

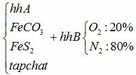
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
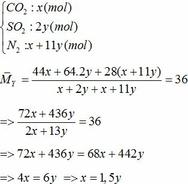
Khối lượng Fe có trong Z là:
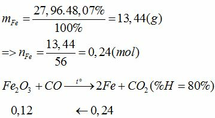
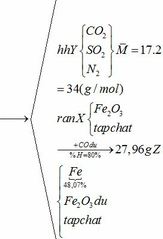
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
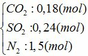
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
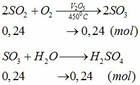
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
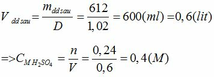

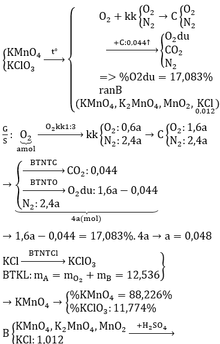
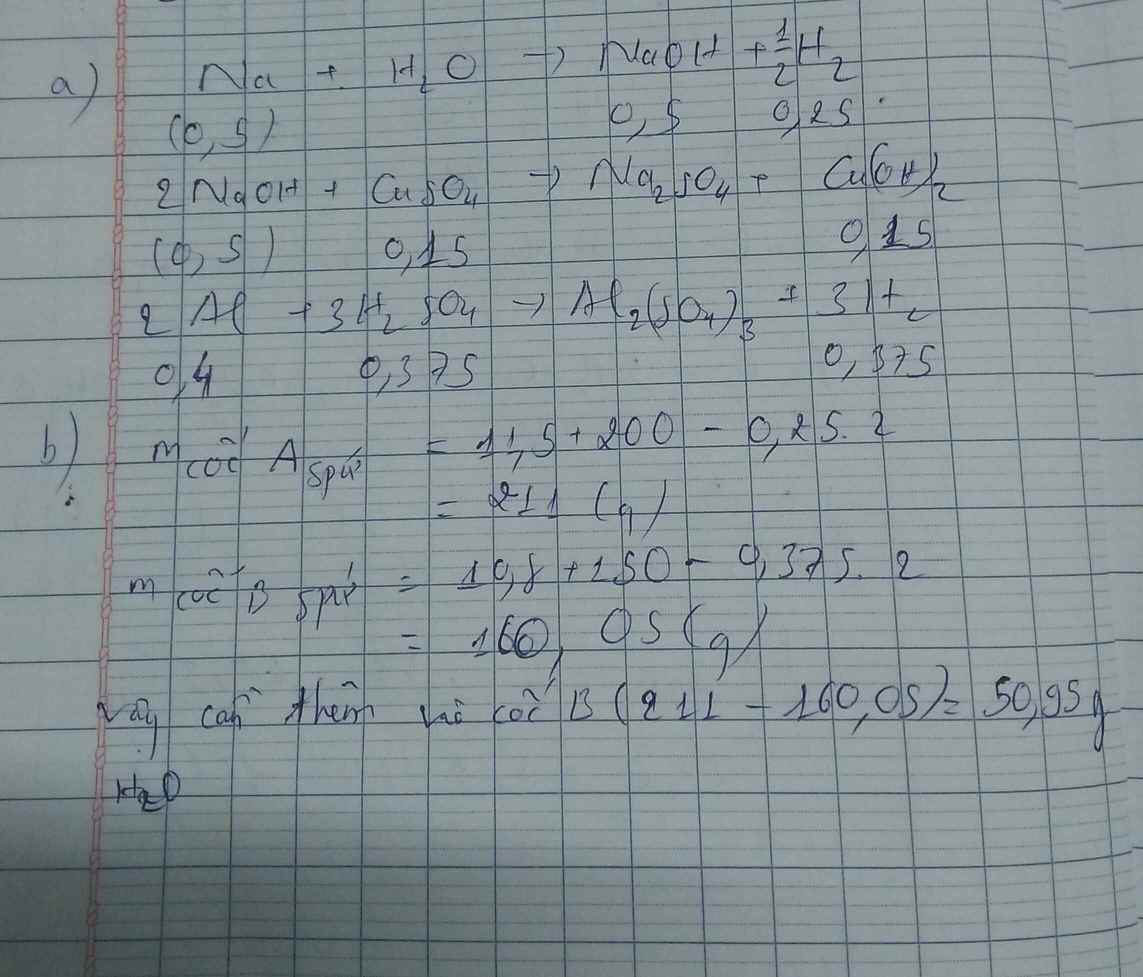


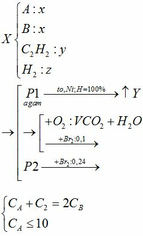
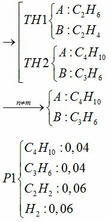
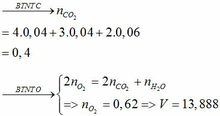

a)
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\) (1)
\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\) (2)
\(n_{KCl}=\dfrac{0,894}{74,5}=0,012\left(mol\right);m_B=\dfrac{0,894}{8,132\%}=11\left(g\right)\)
Gọi \(n_{O_2\left(sinh.ra\right)}=a\left(mol\right)\Rightarrow n_{kk}=3a\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{N_2}=3a.80\%=2,4a\left(mol\right)\\n_{O_2}=a+\left(3a-2,4a\right)=1,6a\left(mol\right)\end{matrix}\right.\)
\(n_C=\dfrac{0,528}{12}=0,044\left(mol\right)\)
\(C+O_2\xrightarrow[]{t^o}CO_2\) (3)
Vì hỗn hợp D gồm 3 khí và O2 chiếm 17,083%
\(\Rightarrow D:CO_2,O_{2\left(d\text{ư}\right)},N_2\)
BTNT C: \(n_{CO_2}=n_C=0,044\left(mol\right)\)
BTNT O: \(n_{O_2\left(d\text{ư}\right)}=n_{O_2\left(b\text{đ}\right)}-n_{CO_2}=1,6a-0,044\left(mol\right)\)
\(\Rightarrow\%V_{O_2}=\%n_{O_2}=\dfrac{1,6a-0,044}{1,6a-0,044+0,044+2,4a}.100\%=17,083\%\)
\(\Leftrightarrow a=0,048\left(mol\right)\left(TM\right)\)
ĐLBTKL: \(m_A=m_B+m_{O_2}=11+0,048.32=12,536\left(g\right)\)
Theo PT (2): \(n_{KClO_3}=n_{KCl}=0,012\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{KClO_3}=\dfrac{0,012.122,5}{12,536}.100\%=11,63\%\\\%m_{KMnO_4}=100\%-11,63\%=88,37\%\end{matrix}\right.\)
b) Theo PT (2): \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4\left(p\text{ư}\right)}+\dfrac{3}{2}n_{KClO_3}\)
\(\Rightarrow n_{KMnO_4\left(p\text{ư}\right)}=2.\left(0,048-\dfrac{3}{2}.0,012\right)=0,06\left(mol\right)\)
\(n_{KMnO_4\left(b\text{đ}\right)}=\dfrac{12,536-0,012.122,5}{158}=0,07\left(mol\right)\)
\(\Rightarrow n_{KMnO_4\left(d\text{ư}\right)}=0,07-0,06=0,01\left(mol\right)\)
\(n_{KCl}=\dfrac{74,5}{74,5}+0,012=1,012\left(mol\right)\)
Theo PT (1): \(n_{K_2MnO_4}=n_{MnO_2}=\dfrac{1}{2}.n_{KMnO_4\left(p\text{ư}\right)}=0,03\left(mol\right)\)
PTHH:
\(2KMnO_4+10KCl+8H_2SO_4\rightarrow6K_2SO_4+2MnSO_4+5Cl_2+8H_2O\) (4)
\(K_2MnO_4+4KCl+4H_2SO_4\rightarrow3K_2SO_4+MnSO_4+2Cl_2+4H_2O\) (5)
\(MnO_2+2KCl+2H_2SO_4\rightarrow MnSO_4+K_2SO_4+Cl_2+2H_2O\) (6)
\(2KCl+H_2SO_4\xrightarrow[]{t^o}K_2SO_4+2HCl\) (7)
Theo PT (4), (5), (6): \(n_{KCl\left(p\text{ư}\right)}=5n_{KMnO_4\left(d\text{ư}\right)}+4n_{K_2MnO_4}+2n_{MnO_2}=0,23\left(mol\right)< 1,012\left(mol\right)=n_{KCl\left(b\text{đ}\right)}\)
`=> KCl` dư
Theo PT (4), (5), (6): \(n_{Cl_2}=\dfrac{1}{2}.n_{KCl\left(p\text{ư}\right)}=0,115\left(mol\right)\)
\(\Rightarrow V_{kh\text{í}}=V_{Cl_2}=0,115.22,4=2,576\left(l\right)\)