Bài1: 9,5 gam hỗn hợp CaO và K vào nước dư.Sau phản ứng thấy có 1,12 lít khí (đktc) thoát ra. Tính % khối lượng mỗi chất trong hỗn hợpBài 2 : Cho 3,6 gam một oxit sắt vào dung dịch HCl dư.Sau phản ứng xảy ra hoàn hoàn thu được 6,35 gam một muối sắt clorua. Xác định công thức của sắtBài 3: Cho 10,4 gam oxit của một nguyên tố kim loại hoá trị 2 tác dụng với dung dịch HCl dư,sau p/ư tạo thành 15,9...
Đọc tiếp
Bài1: 9,5 gam hỗn hợp CaO và K vào nước dư.Sau phản ứng thấy có 1,12 lít khí (đktc) thoát ra. Tính % khối lượng mỗi chất trong hỗn hợp
Bài 2 : Cho 3,6 gam một oxit sắt vào dung dịch HCl dư.Sau phản ứng xảy ra hoàn hoàn thu được 6,35 gam một muối sắt clorua. Xác định công thức của sắt
Bài 3: Cho 10,4 gam oxit của một nguyên tố kim loại hoá trị 2 tác dụng với dung dịch HCl dư,sau p/ư tạo thành 15,9 gam muối.Xác định nguyên tố kim loại
Bài 4 : Cho một dòng khí H2 dư qua 4,8 gam hỗn hợp CuO và một oxit sắt nung nóng thu được 3,52 gam chất rắn.Nếu cho chất rắn đó hoà tan trong axit HCl thì thu được 0,896 lít H2 (đktc).Xác định khối lượng mỗi oxit trong hỗn hợp và xác đijnh công thức của oxit sắt.
Bài 5:
Thả 2,3 gam Na vào 200 gam dung dịch NaOH 5% thấy thoát ra khí.
a) Tính nồng độ % dung dịch sau p/ư
b) Tính nồng độ mol dung dịch sau p/ư biết thể tích là 200ml
Bài 6:
Thả 4 gam Ca vào 200 gam dung dịch NaOH 5% thấy thoát ra khí.
a) Tính nồng độ % dung dịch sau p/ư
b) Cho V=1 lít.Tính nồng độ mol mỗi chất sau p/ư


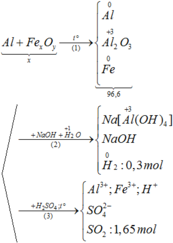
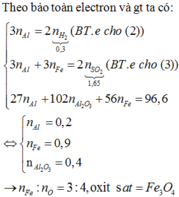
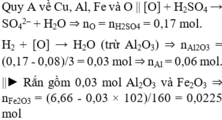
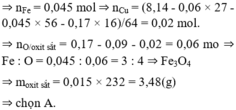

Tham khảo: