Sục 0,112 lít khí HCl (đktc) vào 100ml dung dịch CH3COOH 1M (biết CH3COOH có Ka=1,75.10-5, ở 250C) thì thu được 100ml dung dịch X có pH = x (bỏ qua sự điện ly của nước). Giá trị của x là:
A. 2,82
B. 1,3
C. 3,46
D. 2,0
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do đây là dung dịch đệm nên ta có CT tính nhanh : pH = pKa + log(Cb/Ca) (Ca là nồng độ mol của axit ; Cb là nồng độ mol của muối)
=> pH = 4,28
=>A

Vì muối CH3COONa là chất điện li mạnh nên ta có
![]()
Do đó sau quá trình trên trong dung dịch có nồng độ của ion CH3COO- là 0,1.
Xét cân bằng điện li: CH3COOH + H2O ⇌ CH3COO- + H3O+
Nồng độ ban đầu: 0,1 0,1 0
Nồng độ phân li: x(M) → x x
Nồng độ cân bằng: 0,1 – x 0,1 + x x
Thay các giá trị ở trạng thái cân bằng vào công thức tính hằng số điện li thì ta có
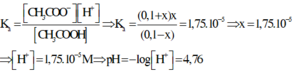
Đáp án D.

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
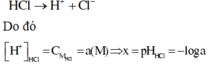
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
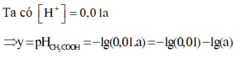
![]()
Đáp án A.

Đáp án : D
Khi nhỏ từ từ HCl vào dung dịch muối thì ban đầu axit rất thiếu nên sẽ có phản ứng :
CO32- + H+ -> HCO3-
HCO3- + H+ -> CO2 + H2O
=> nCO2 = nHCl – nNa2CO3 = 0,05 mol
=>VCO2 = 1,12 lit

Dung dịch X gồm $K^+,CO_3^{2-} , HCO_3^-$
Gọi $n_{CO_3^{2-}\ pư} = a(mol) ; n_{HCO_3^-\ pư} = b(mol)$
Ta có :
$a + b = \dfrac{2,688}{22,4} = 0,12$
$2a + b = n_{HCl} = 0,15$
Suy ra a = 0,03 ; b = 0,09
Trong X, gọi $n_{CO_3^{2-}} = m(mol) ; n_{HCO_3^-} = n(mol)$
Ta có :
$\dfrac{m}{n} = \dfrac{a}{b} = \dfrac{0,03}{0,09} = \dfrac{1}{3}$
Bảo toàn C : $m + n = \dfrac{39,4}{197} = 0,2$
Suy ra m = 0,05 ; n = 0,15
200 ml dung dịch X gồm $0,1(mol)\ CO_3^{2-} ; 0,3(mol)\ HCO_3^-$
Bảo toàn C : $0,2 + x = 0,1 + 0,3 \Rightarrow y = 0,2$
Bảo toàn Kali : $x + 0,2.2 = 0,1.2 + 0,3 \Rightarrow x = 0,1$
Đáp án B