Hỗn hợp X gôm Zn, Fe, Cu.Cho 25 g hỗn hợp X tác dụng với dd HCl dư thu được 6,72 lít H2(đktc). Mặc khác 0,2 mol hỗn hợp X phản ứng vừa đủ với 6,16 lít khí Cl2(đktc). Số mol Cu có trong 25g hỗn hợp X là
A. 0,1
B. 0,05
C. 0,4
D. 0,2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Đặt số mol mỗi kim loại trong 18,5 gam hỗn hợp lần lượt là a, b, c.
Ta có: mhh X =65a + 56b + 64c; n H 2 = a + b = 3 , 92 22 , 4 = 0 , 175 mol
Có số phân tử Cl2 phản ứng trung bình với hỗn hợp X:
n Cl 2 n X = 0 , 175 0 , 15 = 7 6 = ( a + 1 , 5 b + c ) ( a + b + c )
Từ đó ta có a - 2b + c = 0.
Tóm lại ta sẽ có a = b = c = 0,1 mol.
Vậy trong 18,5g hỗn họp X sẽ có 0,1 mol Fe
Chú ý:
Dung dịch axit như dung dịch HCl, HBr, HI hoặc dung dịch H2SO4 có khả năng phản ứng với các kim loại đứng trước H trong dãy điện hóa, tức là trong bài này phản ứng với Zn và Fe tạo ra ZnCl2 và FeCl2.
- Clo có khả năng phản ứng với hầu hết các kim loại (trừ Au, Pt) thậm chí còn có khả năng phản ứng với Ag ở điều kiên thích hợp và đưa kim loại lên số oxi hóa cao nhất vì vậy sản phẩm là ZnCl2,CuCl2,FeCl3

Trong \(20,4g\) hỗn hợp có: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow65a+56b+27c=20,4\left(1\right)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(BTe:2n_{Zn}+2n_{Fe}+3n_{Al}=2n_{H_2}\)
\(\Rightarrow2a+2b+3c=2\cdot0,45\left(2\right)\)
Trong \(0,2mol\) hhX có \(\left\{{}\begin{matrix}Zn:ka\left(mol\right)\\Fe:kb\left(mol\right)\\Al:kc\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow ka+kb+kc=0,2\)
\(n_{Cl_2}=\dfrac{6,16}{22,4}=0,275mol\)
\(BTe:2n_{Zn}+3n_{Fe}+3n_{Al}=2n_{Cl_2}\)
\(\Rightarrow2ka+3kb+3kc=2\cdot0,275\)
Xét thương:
\(\dfrac{ka+kb+kc}{2ka+3kb+3kc}=\dfrac{0,2}{2\cdot0,275}\Rightarrow\dfrac{a+b+c}{2a+3b+3c}=\dfrac{4}{11}\)
\(\Rightarrow3a-b-c=0\left(3\right)\)
Từ (1), (2), (3)\(\Rightarrow\left\{{}\begin{matrix}a=0,1mol\\b=0,2mol\\c=0,1mol\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Zn}=6,5g\\m_{Fe}=11,2g\\m_{Al}=2,7g\end{matrix}\right.\)

TN1: Gọi (nAl; nZn; nFe) = (a; b; c)
=>27a + 65b + 56c = 20,4 (1)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a----------------------->1,5a
Zn + 2HCl --> ZnCl2 + H2
b--------------------->b
Fe + 2HCl --> FeCl2 + H2
c----------------------->c
=> \(1,5a+b+c=0,45\) (2)
TN2: Gọi (nAl; nZn; nFe) = (ak; bk; ck)
=> ak + bk + ck = 0,2 (3)
\(n_{Cl_2}=\dfrac{6,16}{22,4}=0,275\left(mol\right)\)
PTHH: 2Al + 3Cl2 --to--> 2AlCl3
ak-->1,5ak
Zn + Cl2 -to-> ZnCl2
bk--->bk
2Fe + 3Cl2 --to--> 2FeCl3
ck--->1,5ck
=> 1,5ak + bk + 1,5ck = 0,275 (4)
(1)(2)(3)(4) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,1\left(mol\right)\\c=0,2\left(mol\right)\end{matrix}\right.\)
=> \(\%Fe=\dfrac{0,2.56}{20,4}.100\%=54,9\%\)

Gọi $n_{Fe} = a(mol), n_{Zn} = b(mol) , n_{Al} = c(mol) \Rightarrow 56a + 65b + 27c = 20,4(1)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$Zn + H_2SO_4 \to ZnSO_4 + H_2$
$2Al +3 H_2SO_4 \to Al_2(SO_4)_3 +3 H_2$
Theo PTHH : $n_{H_2} = a + b + 1,5c = \dfrac{10,08}{22,4} = 0,45(mol)(2)$
Mặt khác :
$2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
$Zn + Cl_2 \xrightarrow{t^o} ZnCl_2$
$2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3$
Theo PTHH : $n_{Cl_2} = 1,5n_{Fe} + n_{Zn} + 1,5n_{Al}$
Suy ra : \dfrac{1,5a + b + 1,5c}{a + b + c} = \dfrac{0,275}{0,2}(3)$
Từ (1)(2)(3) suy ra : a = 0,2 ; b = 0,1 ; c = 0,1
$\%m_{Fe} = \dfrac{0,2.56}{20,4}.100\% = 54,9\%$
$\%m_{Zn} = \dfrac{0,1.65}{20,4}.100\% = 31,9\%$
$\%m_{Al} = 100\% - 54,9\% - 31,9\% = 13,2\%$

a)
TN1: Gọi (nZn; nFe; nCu) = (a; b; c)
=> 65a + 56b + 64c = 18,5 (1)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
a---------------------->a
Fe + 2HCl --> FeCl2 + H2
b----------------------->b
=> a + b = 0,2 (2)
TN2: Gọi (nZn; nFe; nCu) = (ak; bk; ck)
=> ak + bk + ck = 0,15 (3)
PTHH: Zn + Cl2 --to--> ZnCl2
ak-->ak
2Fe + 3Cl2 --to--> 2FeCl3
bk--->1,5bk
Cu + Cl2 --to--> CuCl2
ck-->ck
=> \(ak+1,5bk+ck=\dfrac{3,92}{22,4}=0,175\)(4)
(1)(2)(3)(4) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,1\left(mol\right)\\c=0,1\left(mol\right)\\k=0,5\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,1.65}{18,5}.100\%=35,135\%\\\%m_{Fe}=\dfrac{0,1.56}{18,5}.100\%=30,27\%\\\%m_{Cu}=\dfrac{0,1.64}{18,5}.100\%=34,595\%\end{matrix}\right.\)
b) nO(oxit) = \(\dfrac{23,7-18,5}{16}=0,325\left(mol\right)\)
=> nH2O = 0,325 (mol)
=> nHCl = 0,65 (mol)
=> \(V=\dfrac{0,65}{1}=0,65\left(l\right)=650\left(ml\right)\)

Gọi số mol của Cu, Fe, Al trong 23,8 gam hhX lần lượt là x, y, z mol
→ mX = 64x + 56y + 27z = 23,8 (1)
\(n_{Cl_2}\) = x + 1,5y + 1,5z = 0,65 (2)
0,25 mol X + HCl → 0,2 mol H2 nên 0,2.(x + y + z) = 0,25.(y + 1,5z) (3)
Từ (1), (2), (3) => x = 0,2 mol; y = 0,1 mol; z = 0,2 mol
\(\%_{Cu} = \dfrac{0,2. 64}{23,8} \approx 53,78\%\)
\(\%_{Fe} = \dfrac{0,1 .56}{23,8} \approx 23,53\%\)
%Al ≈ 22,69%

Đáp án D
Xét trường hợp 20,4 gam A tác dụng với dung dịch HCl dư:
Gọi số mol các chất là Al: a mol; Zn: b mol; Fe: c mol
Ta có:

Các quá trình nhường, nhận electron:
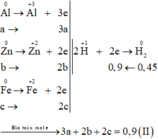
Xét trường hợp 0,2 mol A tác dụng với Cl2:
Gọi số mol các chất là Al: ka mol; Zn: kb mol; Fe: kc mol
Ta có:
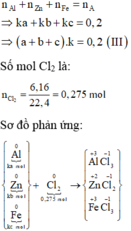
Các quá trình nhường, nhận electron:
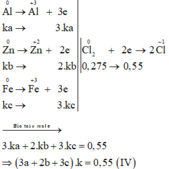
Lấy (IV) chia (III) vế với vế ta được:

Chọn A