Cho 18,5 gam hỗn hợp gồm Fe và Fe3O4 vào 200 ml HNO3 đun nóng. Sau phản ứng thu được 2,24 lít khí NO duy nhất (đktc), dung dịch D và còn lại 1,46 gam kim loại chưa tan. Nồng độ mol/lít của dung dịch HNO3 đã dùng là:
A. 2,7M.
B. 3,2M
C. 3,5M
D. 2,9M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Định hướng tư duy giải
Tư duy đi tắt đòn đầu
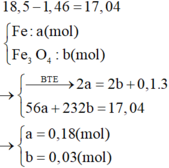
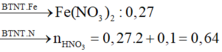
=> [HNO3] = 3,2 (M)

Khối lượng Fe dư là 1,46g, do đó khối lượng Fe và Fe3O4 đã phản ứng là 17,04g. Vì sau phản ứng sắt còn dư nên trong dung dịch D chỉ chứa muối sắt (II).
Sơ đồ phản ứng:
Fe, Fe3O4 + HNO3 → Fe(NO3)2 + NO + H2O
Mol: 2n+0,1 n 0,1 0,5( 2n+0,1)
Đặt số mol của Fe(NO3)2 là n, áp dụng định luật bảo toàn nguyên tố đối với nitơ ta có số mol của axit HNO3 là 2n+ 0,1. Số mol H2O bằng một nửa số mol của HNO3.
Áp dụng định luật bảo toàn khối lượng ta có:
17,04 + 63(2n + 0,1) = 242n + 0,1.30 + 18.0,5(2n + 0,1)
giải ra ta có n = 2,7, suy ra [ HNO3 ] = (2.2,7 + 0,1): 0,2 = 3,2M
Đáp án A

Đáp án A
Do Fe dư nên chỉ tạo ra Fe2+.
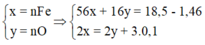
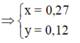
4H+ + NO3- + 3e → NO + 2H2O
2H+ + O + 2e → H2O
=> nHNO3 = nH+ = 4nNO + 2nO = 4.0,1 + 2.0,12 = 0,64
=> [HNO3] = 0,64/0,2 = 3,2M => Chọn A.

Đáp án B
![]()
Vì sau phản ứng còn dư kim loại nên trong dung dịch B tồn tại Fe(NO3)2. Các phản láng xảy ra:
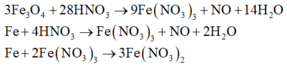
Như vậy trong toàn bộ các quá trình, số oxi hóa của sắt trong Fe và Fe3O4 đều về số oxi hóa +2.

Theo định luật bảo toàn mol electron, ta có:
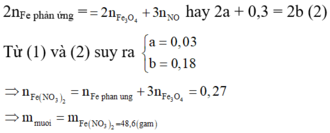

Chọn đáp án A
Quy đổi A về Fe và O, vì có kim loại chưa tan nên xem như Fe chỉ lên Fe+2
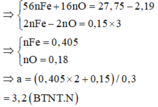
Quy hỗn hợp X thành Fe phản ứng (a mol) và O (b mol) và 1,46 g Fe không tan
Bảo toàn khối lượng => 56a + 16b + 1,46 = 18,5
Đáp án B