Có 500 ml dung dịch X chứa các ion: K+, H C O 3 - ,Cl – và Ba2+ . Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gamkết tủa. Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa . Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa. Mặt khác, nếu đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là
A. 23,700 gam.
B. 14,175 gam.
C. 11,850gam
D. 10,062 gam.



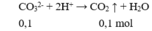
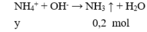
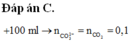
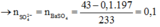
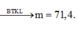

Đáp án C
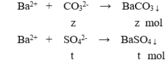
+ Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa⇒ n BaCO3 = n Ba2+ 0,1 mol . Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa
⇒ n BaCO3- = n HCO3- = 0,15 mol
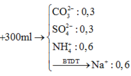
⇒ Trong 100ml ddX có 0,1 mol Ba2+ , 0,15 mol HCO3- .
+ Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa ⇒ Trong 200ml ddX có nCl- = n AgCl = 0,2 mol
⇒ Trong 50ml ddX có 0,05 mol Ba2+ ; 0,075 mol HCO3- , 0,05 mol Cl- ⇒ nK+ = 0,025
2HCO3- → CO32- + CO2 + H2O
0,075 → 0,0375 0,0375(mol)
Khi đun sôi đến cạn: mkhan = m HCO3- + m Ba2+ + m K+ + m Cl- - m CO2 – m H2O
= 0,05.137 + 0,075.61 + 0,05.35,5 + 0,025.39 – 0,0375.44 - 0,0375.18 = 11,85g