Cho 8,16 gam hỗn hợp X gồm Fe, FeO, F e 3 O 4 v à F e 2 O 3 tan hết trong dung dịch H N O 3 loãng (dung dịch Y), thu được
1,344 lít NO (đktc) và dung dịch Z. Dung dịch Z hòa tan tối đa 5,04 gam Fe, sinh ra khí NO. Biết trong các phản ứng, NO là sản phẩm khử duy nhất của N 5 + . Số mol H N O 3 có trong Y là
A. 0,78 mol
B. 0,54 mol
C. 0,50 mol
D. 0,44 mol






Đáp án C
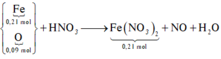
Fe + ddZ → khí NO => X chứa H N O 3 dư. Quy X về Fe và O
Trong X, đặt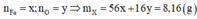
Bảo toàn electron:
Giải hệ có: x = 0,12 mol; y = 0,09 mol
Xét cả quá trình : do hòa tan tối đa Fe => Fe chỉ lên số oxi hóa +2.
Xét cả quá trình : do hòa tan tối đa Fe => Fe chỉ lên số oxi hóa +2.