Cho 18,5 gam hỗn hợp A gồm Fe, Fe3O4 tác dụng với 200ml dung dịch HNO3 a (mol/lít). Sau khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí NO duy nhất (đktc), dung dịch B và 1,46 gam kim loại.Khối lượng muối trong B là:
A. 65,34g
B. 48,6g
C. 54,92g
D. 39,5g


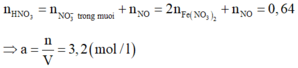
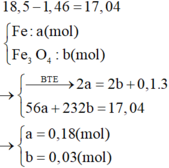
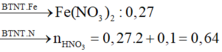
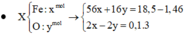
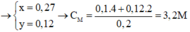
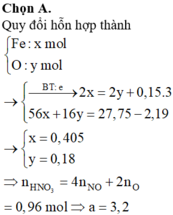
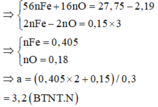
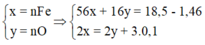
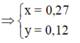
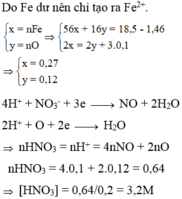


Đáp án B
Vì sau phản ứng còn dư kim loại nên trong dung dịch B tồn tại Fe(NO3)2. Các phản láng xảy ra:
Như vậy trong toàn bộ các quá trình, số oxi hóa của sắt trong Fe và Fe3O4 đều về số oxi hóa +2.
Theo định luật bảo toàn mol electron, ta có: