Cho m gam hỗn hợp X gồm Ba, BaO, Al vào nước dư sau khi phản ứng kết thúc thu được dung dịch A, 3,024 lít khí (đktc) và 0,54 gam chất rắn không tan. Rót 110 ml dung dịch HCl 1M vào dung dịch A thu được 5,46 gam kết tủa. m có giá trị là:
A. 7,21 gam
B. 8,74 gam
C. 8,2 gam
D. 8,58 gam


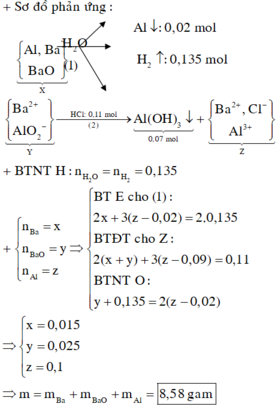
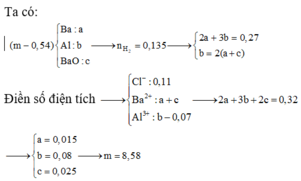






Định hướng tư duy giải
Trong A