Hợp chất A được tạo thành từ cation X + và anion Y 2 - . Mỗi ion đều do 5 nguyên tử của hai nguyên tố tạo nên. Tổng số proton trong X + là 11, tổng số electron trong Y 2 - là 50. Biết rằng hai nguyên tố trong Y 2 - đều thuộc cùng một nhóm A và thuộc hai chu kì liên tiếp. Phân tử khối của A là
A. 96
B. 78
C. 114
D. 132


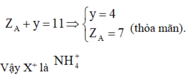
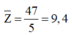


D
Xét ion X + : có 5 nguyên tử, tổng số proton là 11. Vậy số proton trung bình là 2,2.
=> Có 1 nguyên tử có số proton nhỏ hoặc bằng 2 và tạo thành hợp chất. Vậy nguyên tử đó là H
Số electron trung bình của các nguyên tử trong Y 2 - là 9,6
=> Có 1 nguyên tử có số electron nhỏ hơn 9,6
=> Nguyên tử của nguyên tố thuộc chu kì 2.
=> Nguyên tử của nguyên tố còn lại thuộc chu kì 3.
Nếu 2 nguyên tố cùng thuộc một nhóm A thì sẽ hơn kém nhau 8 electron