Cho 200ml dung dịch Al2(SO4)3 1M vào 700ml dung dịch Ba(OH)2 1M. Phản ứng kết thúc thu được kết tủa nung kết tủa tới khối lượng không đổi thu được m gam chất rắn. Giá trị của m là
A. 150 gam
B. 20,4 gam
C. 160,2 gam
D. 139,8 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D.
nBa(OH)2 đầu = 0.15 => nOH- = 0.3
nAl2(SO4)3 = 0.25x => nAl3+ = 0.5x và nSO4(2-) = 0.75x
Khi cho 150ml Ba(OH)2 vào dd thu được 42.75g kết tủa
Thêm tiếp 200ml
=> m kết tủa theo lí thuyết = 350*42.75/150 = 99.75g > 94.2375g
=> Lúc đầu chưa tạo kết tủa cực đại, Al2(SO4)3 dư ; sau khi thêm Ba(OH)2 vào thì pứ tạo kết tủa
lớn nhất và sau đó Ba(OH)2 dư sẽ hòa tan thêm một phần kết tủa
+ Khi chưa thêm: (tính theo nBa(OH)2)
Ba2+ + SO42- ---> BaSO4
0.15 0.15 0.15
Al3+ + 3OH- ----> Al(OH)3
0.1 0.3 0.1
+ Khi thêm Ba(OH)2 vào: (tính theo nAl2(SO4)3)
Ba2+ + SO42- ---> BaSO4
0.75x-0.15 0.75x-0.15
Al3+ + 3OH- ---> Al(OH)3
0.5x-0.1 1.5x-0.3 0.5x-0.1
OH- dư + Al(OH)3 --->AlO2- + 2 H2O
0.4-1.5x+0.3 0.7-1.5x
Ta có:
m kết tủa lúc sau = m kết tủa ban đầu + mBaSO4 sau + mAl(OH)3 chưa tan lúc sau = 42.75 + 233*(0.75x-0.15) +
78*(0.5x-0.1-0.7+1.5x)
=> 330.75x - 54.6 = 94.2375
=> x = 0.45

Chọn đáp án C
Chú ý :
(1). Trong bài toán này người ta không vớt kết tủa lần đầu ra mà cứ để yên rồi đổ thêm Ba(OH)2 vào.
(2). Để mò ra đáp án nhanh bài toán này các bạn cần tư duy nhanh xem lượng kết tủa ở lần 1 và 2 có bị tan phần nào không.Điều này khá đơn giản.
+Nhìn nhanh qua đáp án cũng khẳng định được ở lần 1 muối sunfat có dư.
+Khi đổ thêm Ba(OH)2 dễ thấy Al(OH)3 bị tan vì khi x = 0,45 vẫn bị tan
Khi đó ta có
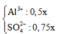
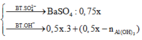
![]()
![]()
Vậy
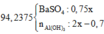
![]()
![]()
Bài này các bạn cũng có thể dùng thủ đoạn truyền thống “thử đáp án”

Tính toán theo PTHH :
Mg + CuSO4 → Cu + MgSO4
Mg + FeSO4 → Fe + MgSO4
Ba(OH)2 + MgSO4 → BaSO4 + Mg(OH)2
Ba(OH)2 + FeSO4 → BaSO4 + Fe(OH)2
Mg(OH)2 → MgO + H2O
2 Fe(OH)2 + ½ O2 → Fe2O3 + 2 H2O
Giả sư dung dịch muối phản ứng hết
=> n Fe = n FeSO4 = 0,2 . 1= 0,2 mol => m Fe = 0,2 . 56 = 11,2 g
=> n Cu =n CuSO4 = 0,2 . 0,5 = 0,1 mol => m Cu = 0,1 . 64 = 6,4 g
=> m chất rắn = 11,2 + 6,4 = 17,6 g > 12 g > 6,4
=> kim loại Fe dư sau phản ứng Vì CuSO4 phản ứng trước sau đó mới đến FeSO4 phản ứng
CuSO4 đã hết và phản ứng với 1 phần FeSO4
12 g = m Cu + m Fe phản ứng = 6,4 g + m Fe phản ứng
=> m Fe = 5,6 g => n Fe = 0,1 mol => n FeSO4 dư = 0,2 – 0,1 = 0,1 mol
Theo PTHH : n Mg = 0,1 + 0,1 = 0,2 mol ( bắng số mol CuSO4 và FeSO4 phản ứng )
Theo PTHH : n Mg = n MgSO4 = n Mg(OH)2 = n MgO = 0,2 mol
n FeSO4 dư = n Fe(OH)2 = n Fe2O3 . 2 = 0,1 mol
=> n Fe2O3 = 0,1 mol
=> m chất rắn = m Fe2O3 + m MgO = 0,1 . 160 + 0,2 . 40 = 24 g

Đáp án C
Nhận thấy sau 1 thời gian mới bắt đầu xuất hiện kết tủa → chứng tỏ trong dung dịch chứa H+ dư
Dựa vào đồ thị tại 17a mol OH- kết tủa không đổi → chỉ chứa Mg(OH)2 : 2a mol → nMg= 2a mol
Lượng kết tủa cực đại chứa Mg(OH)2 : 2a mol, Al(OH)3 : 3a mol → nAl2O3 = 1,5a mol
→ 2a. 24+ 1,5a . 102 = 12, 06 → a = 0,06 mol
Gọi số mol của HCl và H2SO4 lần lượt là0,5b và 0,1b
Dung dịch X chứa Mg2+ : 0,12 mol, Al3+ : 0,18 mol, Cl-:0,5b mol, SO42- :0,1b mol H+ dư : 0,7b- 0,78 ( bảo toàn điện tích)
Tại thời điểm 17a mol OH- thì nOH- = 4nAl3+ + 2nMg2+ + nH+ dư → 17. 0,06 = 4. 0,18 + 2.0,12 + 0,7b- 0,78 → b = 1,2
Khi thêm :
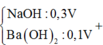


Kết tủa cực đại khi chưa ra sự hòa tan kết tủa thì nOH- = nH+ dư + 2nMg2+ + 3nAl3+ = 0,84
→ 0,5V = 0,84 → V = 1,68 lít → nBa2+ = 0,168 mol
Khi đó nBaSO4 = nSO42- = 0,12 mol
Chất rắn khan chứa BaSO4:0,12 mol; MgO: 0,12 mol; Al2O3: 0,09 mol → m = 41,94 gam

Giải thích:
Dd X + NaOH → Mg(OH)2 + Al(OH)3
Lượng kết tủa khi NaOH dư là nMg(OH)2 = 2a
→ lượng kết tủa tối đa là nAl(OH)3 = n↓ - nMg(OH)2 = 5a - 2a =3a
→ nMg : nAl2O3 = 2a : = 4 : 3
Mà mhỗn hợp = 24nMg + 102nAl2O3 = 12,06 → nMg = 0,12 mol và nAl2O3 = 0,09 mol
→ a = 0,06 mol → nOH = 17a = 1,02 = nH+ (X) + 2nMg + 8nAl2O3 = nH+(X) + 0,96 → nH+(X) = 0,06 mol
Bảo toàn điện tích trong dung dịch X có nH+(X) + 2nMg2+ + 3nAl3+ = nCl- + 2nSO4 = 0,84
Mà nCl : nSO4 = 5 : 1 nên nCl- = 0,6 mol và nSO4 = 0,12 mol
X có Cl- : 0,6 mol SO42- : 0,12 mol, H+ : 0,06 mol, Al3+ : 0,18 mol và Mg2+ : 012 mol
Dd thêm vào có Ba2+ : x mol, Na+ : 3x mol ; OH- : 5x mol
Để thu được kết tủa tối đa thì ta có tạo kết tủa Al(OH)3 và Mg(OH)2 tối đa
nOH- = 5x = 0,18.3 +0,12.2 =0,78 mol
Khi đó Ba2+ : 0,156 → nBaSO4= 0,12 → ↓ BaSO4 : 0,12 mol; Al(OH)3 : 0,18 mol; Mg(OH)2 : 0,12 mol
→ nung thu được 0,12 mol BaSO4; 0,09 mol Al2O3 và 0,12 mol MgO
→ m =41,94
Đáp án D
Nhận thấy 3 < nOH- : nAl3+ = 1,4 : 0,4 < 4 → xảy ra quá trình hòa tan kết tủa
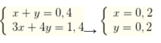
Al3+ + 3OH- → Al(OH)3↓
x------3x
Al3+ + 4OH- → Al(OH)4-
y-------4y
Ba2+ + SO42- → BaSO4↓
0,7-----0,6------->0,6
Ta có hệ
Vậy kết tủa gồm nAl(OH)3 = 0,2 mol, nBaSO4 = 0,6 mol
Nung kết tủa đến khối lượng không đổi: Al2O3: 0,1 mol và nBaSO4 = 0,6 mol → mchất rắn = 150 gam.
Đáp án A