Dùng khí hiđro để khử hết 50g hỗn hợp A gồm đồng(II)oxit và sắt(III)oxit. Biết trong hỗn hợp sắt(III)oxit chiếm 80% khối lượng.
a) Tính khối lượng mỗi chất trong hỗn hợp
b) Tính thể tích hiđro (đktc) đã dùng
c) Tính khối lượng kim loại đồng sắt thu được



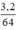 = 0,05 mol
= 0,05 mol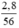 = 0,05 (mol)
= 0,05 (mol)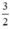 . n
. n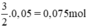 ⇒ V
⇒ V
mFe2O3=80%.50=40(g)
=>nFe2O3=40/160=0,25(mol)
mCuO=50-40=10(g)
=>nCuO=10/80=0,125(mol)
Fe2O3+3H2--t*-->2Fe+3H2O
0,75____0,75
CuO+H2--t*-->Cu+H2O
0,125__0,125
ΣH2=ΣH2=0,75+0,125=0,875(mol)
=>VH2=0,875.22,4=19,6(l)
từ đó bạn suy ra =>