Bài 1: X có 2 loại đồng vị là X1 và X2. Tổng số hạt trong X1 là 54 hạt và trong X2 là 52 hạt. Biết X1 chiếm 25% và X2 chiếm 75%. Tính khối lượng nguyên tử trung bình của X.
Bài 2: Tổng số 3 loại hạt trong một nguyên tử Y là 82. Trong đó số hạt không mang điện nhiều hơn số hạt mang điện dương là 4 hạt.
a) Tìm số proton và số khối của Y.
b) Viết kí hiệu nguyên tử Y.
Bài 3: Cho 200ml dung dịch NaOH nồng độ 1M vào dung dịch chứa 10,95 gam HCl.Sau phản ứng thu được dung dịch A.
a) Cho mẫu quỳ tím vào dung dịch A thì có hiện tượng gì xảy ra?
b) Hòa tan hoàn toàn a gam kim loại sắt vào dung dịch A thì thấy có V lít khí thoát ra(ở đktc).Hãy xác định a và V.


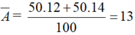
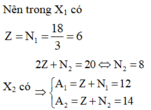

1.Ta có: 2p+n1=54 ; 2p+n2=52
=>P=17=>n1=20=>n2=18
=>R=0,25∗37+0,75∗35=35,5
2
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố X là 82:
p + e + n = 82 hay 2p + n = 82 (do p = e) (1)
Số hạt mang điện (p và e) nhiều hơn số hạt không mang điện (n) là 22 hạt
(p+e) – n = 22 hay 2p – n = 22 (2)
Giải (1), (2) ta có p = e = 26; n =30
Số khối của X = Z + N = p + n =56
Bài 2:
a: Theo đề, ta có:
\(\left\{{}\begin{matrix}2Z+N=82\\Z-N=-4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}3Z=78\\Z-N=-4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}Z=26\\N=Z+4=30\end{matrix}\right.\)
A=26+30=56
b: Y: \(^{56}_{26}Fe\)